Intensification du procédé AAV grâce à une lyse à forte salinité et une endonucléase tolérante au sel
- Facteurs à prendre en compte pour la lyse cellulaire
- Facteurs à prendre en compte pour la digestion de l'ADN
- Développement d'une endonucléase tolérante au sel pour la production de vecteurs AAV
- Sélection de la nucléase Benzonase® adaptée à votre application
- Le défi de l'utilisation d'une salinité élevée
- FAQ Benzonase®
- FAQ Deviron®
La production de vecteurs AAV (virus adéno-associé) intègre une étape intermédiaire qui combine lyse cellulaire et traitement par nucléase. À ce stade, l'utilisation de détergents permet de rompre la bicouche lipidique des cellules afin de libérer les vecteurs, tandis que l'ADN des cellules hôtes et les plasmides résiduels sont digérés par l'endonucléase afin de garantir la sécurité du patient et d'améliorer l'efficacité des procédés en aval. En vertu des recommandations du guide d'applications Guidance for Gene Therapy Investigational New Drug Applications 2020, émis par la FDA, l'ADN résiduel doit subir une réduction inférieure à 10 ng/dose et la taille du fragment doit être inférieure à environ 200 paires de base.
Cette page présente les facteurs essentiels de la lyse cellulaire ainsi que l'utilisation combinée d'une concentration en sel élevée et d'une endonucléase tolérante au sel pour augmenter le titre du vecteur et l'infectivité.
Facteurs à prendre en compte pour la lyse cellulaire
Malgré sa simplicité apparente, l'étape de lyse cellulaire présente plusieurs difficultés. Les détergents fréquemment utilisés dans la lyse cellulaire, notamment le TRITON™ X-100 (4-tert-octylphénol polyéthoxylate) peuvent en effet s'avérer problématiques. En janvier 2021, suite à son inscription sur la liste du règlement REACH (Registration, Evaluation, Authorization and Restriction of Chemicals, Enregistrement, évaluation, autorisation et restriction des produits chimiques), la Commission européenne a interdit toute utilisation non autorisée du TRITON™ X-100 au sein de l'Union européenne. Les effets endocriniens et mutagènes du produit de dégradation du TRITON™ X-100, considérés comme dangereux pour les patients et pour l'environnement, ainsi que les lignes directrices strictes concernant son utilisation dans l'UE, justifient son inscription sur la liste.
D'autres facteurs sont aussi à prendre en compte lors du choix du détergent pour la lyse cellulaire : le détergent ne doit pas endommager les vecteurs viraux ni nuire à l'infectivité des particules virales. Il ne doit pas non plus interférer avec le procédé en aval, comme c'est le cas avec les polysorbates. Le détergent sélectionné doit également pouvoir être modifié à des fins d'élimination et de détection lors des étapes ultérieures du flux de travail.
Enfin, il est important de comprendre l'impact de la concentration en sel sur la lyse cellulaire et le rendement du vecteur. Historiquement, les tampons de lyse utilisés pour la libération des capsides d'AAV contenaient une concentration physiologique en sel (150 mM de NaCl). Cependant, de récentes publications ont rapporté qu'une hausse de la salinité à 500 mM permettait d'augmenter le nombre de particules de vecteurs et les titres infectieux, tout en diminuant l'agrégation des AAV. Néanmoins, tel que décrit plus bas, une forte salinité peut avoir un impact négatif sur l'activité des endonucléases classiques utilisées pour la digestion de l'ADN dans le procédé de fabrication des vecteurs AAV.
Effet d'une salinité élevée lors des étapes intermédiaires sur le rendement en AAV
Une étude a été menée pour déterminer l'impact d'une concentration en sel plus importante lors de la lyse cellulaire. Dans le cadre de cette étude, des vecteurs AAV5 ont été produits dans des cellules HEK293, lysées à l'aide de TRITON™ X-100, de polysorbate 20, de Deviron® C16 ou de Deviron® 13-S9. Le nombre de référence de capsides produites par un procédé a été défini avec 150 mM de NaCl dans un tampon de lyse à base de polysorbate 20. L'utilisation de 500 mM de sel dans le tampon de lyse a permis d'augmenter les titres des capsides d'AAV5 de 29 % en moyenne (Figure 1).

Figure 1.Impact d'une lyse à forte salinité sur la production de titres d'AAV5.
Effet d'une salinité élevée lors des étapes intermédiaires sur l'infectivité des AAV
Pour mesurer les effets de l'utilisation de 500 mM de NaCl sur l'infectivité des AAV, une étude similaire a été réalisée. Lors de cette étude, des vecteurs AAV2 ont été produits dans des cellules HEK293. Les conditions du tampon de lyse de référence étaient les suivantes : 150 mM de NaCl et polysorbate 20. En augmentant la concentration en sel à 500 mM et en utilisant différents détergents, une hausse de l'infectivité d'au moins 10× a été observée (Figure 2). Comme indiqué ci-dessus, l'utilisation d'une forte teneur en sel lors de la lyse présente un autre avantage : la diminution de l'agrégation des AAV.
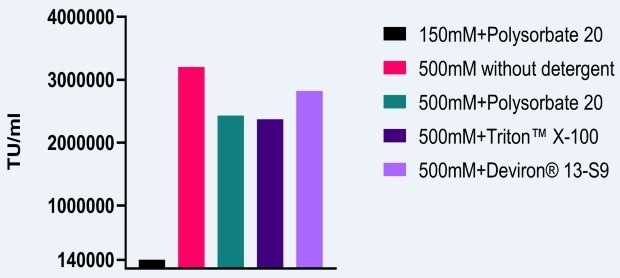
Figure 2.Incidence d'une lyse à forte salinité sur l'infectivité des AAV5.
Facteurs à prendre en compte pour la digestion de l'ADN
Comme pour l'étape de lyse cellulaire, la digestion de l'ADN présente également plusieurs problématiques. L'une des plus importantes repose sur la nécessité de trouver des matériaux de qualité adéquate pour répondre aux exigences réglementaires et garantir la fiabilité de la chaîne d'approvisionnement. Outre les BPF, la pureté, l'état de glycosylation et la biocharge sont autant de facteurs à prendre en considération. La tolérance de l'enzyme à une salinité élevée est également un facteur critique empêchant l'utilisation d'une forte teneur en sel lors de la fabrication des AAV.
Principaux critères pour le choix de l'enzyme lors de la fabrication des AAV
- BPF IPEC/PQG ou équivalence disponible, DMF/BBFM (FDA).
- Produit pur >99 %
- Absence de modifications post-traductionnelles
- Recherche de mycoplasmes
- Recherche de virus adventices
- Recherche d'endotoxines
- Disponibilité d'échantillons avant livraison du produit lui-même
- Logistique et approvisionnement robustes
- Assistance technique pour toutes questions liées aux applications
- Méthode de détection précise
L'enzyme utilisée pour la digestion de l'ADN doit également être éliminée efficacement lors des procédés en aval, et son activité à la teneur en sel appliquée doit être prise en compte. Bien qu'une teneur plus élevée en sel puisse améliorer le rendement des vecteurs, l'interaction entre les enzymes endonucléases classiques et l'ADN ne survient pas à une concentration ionique élevée, ce qui empêche le clivage de l'acide nucléique. Par conséquent, l'activité nucléase souhaitée et la salinité devaient être bien équilibrées.
Développement d'une endonucléase tolérante au sel pour la production de vecteurs AAV
Pour satisfaire la demande d'une endonucléase ayant une activité efficace à des concentrations élevées en sel afin que la lyse cellulaire soit plus efficace, nous avons utilisé des capacités d'ingénierie des protéines avancées pour développer l'endonucléase tolérante au sel Benzonase®. Cette endonucléase d'origine non animale peut digérer l'ADN et l'ARN à des concentrations en sel jusqu'à 1 000 mM, est conforme aux BPF IPEC/PQG et fait partie de la gamme de produits Emprove® Expert.
Un système d'expression en cellules bactériennes est utilisé pour produire l'endonucléase tolérante au sel Benzonase®. Ce système garantit en effet une taille moléculaire définie avec précision, l'absence de modifications post-traductionnelles et une reproductibilité d'un lot à l'autre élevée. Les données suivantes témoignent de l'activité et des avantages de l'endonucléase tolérante au sel Benzonase®.
Profil protéique
Un système d'expression en cellules bactériennes est utilisé pour produire l'endonucléase tolérante au sel Benzonase®. Ce système garantit en effet une taille moléculaire définie avec précision, l'absence de modifications post-traductionnelles et une reproductibilité d'un lot à l'autre élevée. Le profil homogène de la protéine permet une détection précise avec les immunodosages (comme ELISA), contrairement aux enzymes exprimées dans la levure, qui sont fortement glycosylées et présentent une variabilité post-traductionnelle élevée d'un lot à l'autre.

Figure 3.Identité et pureté de l'endonucléase tolérante au sel Benzonase® et du concurrent A, telles que démontrées par SDS-PAGE en conditions réductrices.

Figure 4.Identité et pureté de l'endonucléase tolérante au sel Benzonase® et du concurrent A, telles que démontrées par SDS-PAGE en conditions non réductrices.
La production dans E. coli à partir de l'endonucléase tolérante au sel Benzonase® Emprove® Expert montre :
- Des protéines propres et pures
- L'absence de modifications post-traductionnelles
- Une reproductibilité d'un lot à l'autre élevée
Les Figures 3 et 4 mettent en évidence que l'endonucléase tolérante au sel Benzonase® Emprove® Expert présente une taille moléculaire précise, contrairement à l'endonucléase de référence (Comp A) tolérante au sel.
Activité de l'endonucléase
Les endonucléases ont besoin de magnésium pour leur activité. La Figure 5 compare l'activité de l'endonucléase tolérante au sel Benzonase® à celle de nucléases non tolérantes au sel, à différentes concentrations de magnésium. Il apparaît qu'une forte salinité améliore l'activité de l'endonucléase tolérante au sel Benzonase®, avec une activité stable sur des plages comprises entre 1 et 10 mM de Mg2+ et 500 mM de sel. À 150 mM et 500 mM de sel, l'activité de l'endonucléase tolérante au sel Benzonase® est similaire à celle d'une nucléase standard avec 10 mM de Mg2+ (Figure 6).
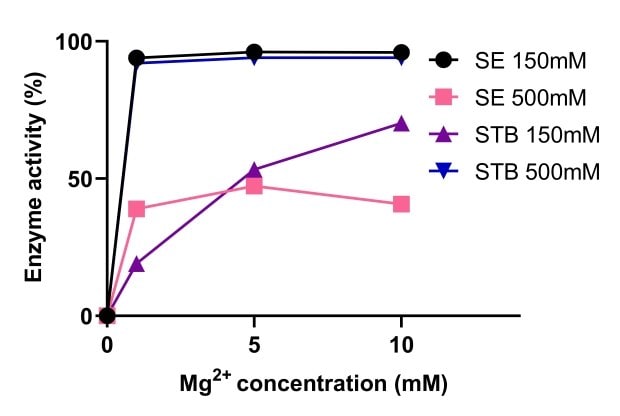
Figure 5.Comparaison de l'activité de l'endonucléase tolérante au sel Benzonase® à une endonucléase non tolérante au sel.
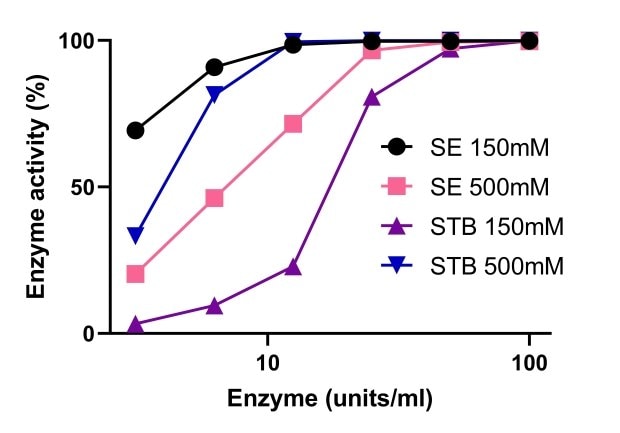
Figure 6.Comparaison de l'activité de l'endonucléase tolérante au sel Benzonase® à une endonucléase non tolérante au sel.
La Figure 7 présente les résultats d'une étude au cours de laquelle l'ADN a été digéré à l'aide de l'endonucléase tolérante au sel Benzonase® et d'autres endonucléases disponibles dans le commerce, tolérantes et non tolérantes au sel, à des concentrations de 500 mM et 1 M de NaCl, pendant une heure à 37 °C. L'endonucléase tolérante au sel Benzonase® a complètement digéré l'ADN à 500 mM et 1 M de sel et a démontré des performances similaires ou supérieures par rapport aux autres endonucléases.

Figure 7.Comparaison de la digestion de l'ADN avec l'endonucléase tolérante au sel Benzonase® et une autre endonucléase, disponible dans le commerce, tolérante et non tolérante au sel, pendant une heure à 37 °C.
Légende
M – Échelle d'ADN à plage très faible GeneRuler réf. SM1213
Comp A ** – Endonucléase tolérante au sel concurrente
SE – Endonucléase standard (réf. 103773, par exemple)
STB – Endonucléase tolérante au sel Benzonase® Emprove® Expert
Taille des fragments de l'acide nucléique
L'endonucléase tolérante au sel Benzonase® digère l'ADN à des niveaux indétectables en deçà de la taille de 10 paires de base. La Figure 8 présente des fragments d'ADN sur un gel d'agarose à 4 %, identifiés avec un marqueur d'ADN de faible poids moléculaire. À une concentration de 150 mM de sel, la digestion de l'ADN n'était pas totale ; à 500 mM de sel, aucun fragment d'ADN résiduel n'a été observé post-digestion.

Figure 8.Fragment d'ADN d'une taille de 25 U/ml post-digestion avec l'endonucléase tolérante au sel Benzonase®, à 37 °C pendant 30 minutes.
Compatibilité de l'endonucléase tolérante au sel Benzonase® avec des détergents en production de vecteurs AAV
L'activité de l'endonucléase tolérante au sel Benzonase® a été évaluée en association avec quatre détergents différents, utilisés pour la lyse cellulaire : TRITON™ X-100, polysorbate 20 et deux détergents alternatifs développés en réponse à l'interdiction d'utilisation du TRITON™ X-100, à savoir les produits Deviron® C16 et 13-S9. Comme l'illustre la Figure 9, aucun des quatre détergents utilisés n'a eu d'incidence sur l'activité de l'endonucléase tolérante au sel Benzonase®. L'ADN a été complètement digéré dans le tampon de lyse à 500 mM de NaCl avec le TRITON™ X-100, le polysorbate 20 et le Deviron® 13-S9 (7B).
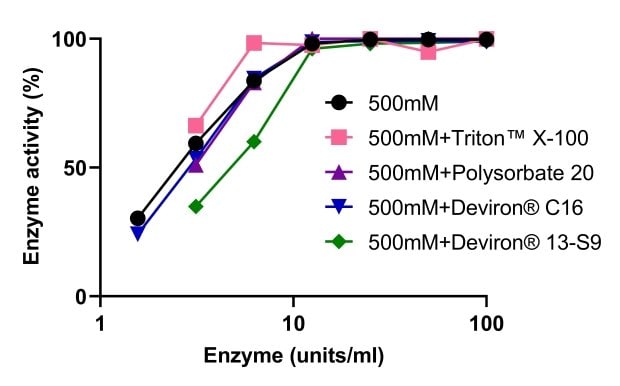
Figure 9.Activité de l'endonucléase tolérante au sel Benzonase® lorsqu'elle est utilisée en association avec différents détergents.

Figure 10.Digestion de l'ADN avec l'endonucléase tolérante au sel Benzonase® utilisée en association avec différents détergents.
Sélection de la nucléase Benzonase® adaptée à votre application
L'endonucléase tolérante au sel Benzonase® est destinée à des applications impliquant des teneurs en sel supérieures ou égales à 200 mM. À une concentration de 500 mM de sel, la digestion de l'ADN est totale avec, comme indiqué ci-dessus, possibilité d'augmenter de 29 % le titre d'AAV et de presque 2 000 % l'infectivité. Dans cette étape intermédiaire, la sécurité du patient est accrue avec une concentration élevée en sel, étant donné que l'agrégation des AAV est réduite et que l'ADN est éliminé efficacement des capsides virales. Le profil post-traductionnel de l'endonucléase tolérante au sel Benzonase® assure également l'utilisation d'une protéine non glycosylée et facile à détecter en production de médicaments.
Pour les applications impliquant des concentrations en sel inférieures à 200 mM, il convient d'utiliser l'endonucléase standard Benzonase® Safety Plus.
Le Tableau 3 résume les caractéristiques de nos trois références d'endonucléases Benzonase®, conformes aux BPF. L'endonucléase tolérante au sel Benzonase® fait partie du programme Emprove®, qui permet aux fabricants de limiter les interruptions et de mener des évaluations de risques approfondies lors de la transition du développement à l'étape de fabrication. Le programme propose des matières premières et des matériaux de départ, rigoureusement qualifiés dans le respect des normes les plus strictes du secteur. Ces matières et matériaux s'accompagnent d'une documentation complète répondant aux besoins d'information des fabricants pharmaceutiques dans le cadre de la qualification des matières premières, de l'évaluation des risques ou de l'optimisation d'un procédé de fabrication.
Le défi de l'utilisation d'une salinité élevée
En production d'AAV, l'utilisation d'une salinité élevée lors de l'étape de lyse cellulaire permet d'obtenir des titres plus élevés et d'améliorer l'infectivité. Cependant, jusqu'à présent, cette approche était peu réalisable sur le plan pratique, dans la mesure où les conditions de salinité élevée inhibaient l'activité des endonucléases classiques utilisées pour la digestion de l'ADN.
Le développement de l'endonucléase tolérante au sel Benzonase® permet d'intégrer des concentrations en sel de l'ordre de 500 mM durant l'étape intermédiaire de lyse et de digestion de l'ADN. L'endonucléase est également compatible avec tous les détergents testés, y compris les détergents Deviron® qui constituent des alternatives au TRITON™ X-100.
Pour demander un échantillon de l'endonucléase tolérante au sel Benzonase® ou d'un produit de la gamme Deviron®, cliquez sur le lien ci-dessous pour remplir notre court formulaire en ligne.
FAQ Benzonase®
Définition
Qu'est-ce que l'endonucléase Benzonase® ?
Benzonase® est une marque commerciale détenue par Merck, qui regroupe des endonucléases utilisées dans des applications de recherche et de bioprocessing.
Quelles sont les enzymes reprises sous ce nom de marque commerciale ?
La gamme des endonucléases Benzonase® compte actuellement deux enzymes différentes.
- L'ancienne gamme de produits Benzonase®, incluant l'endonucléase Benzonase® Safety Plus, isolée à partir de Serratia marcescens, et produite de façon recombinante dans la souche E. coli K12 W3110. Cette protéine présente un poids moléculaire de 30 kDa et un point isoélectrique (pI) de 6,85.
- La nouvelle endonucléase tolérante au sel Benzonase® (1.4445), conçue avec une ingénierie des protéines de pointe, afin de garantir une activité maximale à des concentrations élevées en sel.
Cette protéine est un monomère d'un poids moléculaire d'environ 27 kDa et présentant un pl à pH 9,68. Une rubrique de cetteFAQ est consacrée à cette enzyme.
Mode d'action
Sur quel type d'acides nucléiques la nucléase Benzonase® agit-elle ? Puis-je l'utiliser lors de l'isolement d'ARN ?
La nucléase Benzonase® est une endonucléase dite de proximité qui attaque et dégrade toutes les formes d'ADN et d'ARN (simple brin, double brin, linéaire et circulaire).
Quel est le résultat final de la dégradation totale de l'acide nucléique par la nucléase Benzonase® ?
La nucléase Benzonase® digère complètement les acides nucléiques en oligonucléotides à terminaison 5'-monophosphate d'une longueur de 2 à 5 bases.
Inhibition et élimination
Comment inactiver la nucléase Benzonase® ? Comment l'éliminer ?
Une inhibition réversible peut être obtenue avec de l'EDTA pour chélater les ions métalliques essentiels. Seules des conditions extrêmes (100 mM de NaOH à 70 °C pendant 30 minutes) permettent d'obtenir une inactivation irréversible. La nucléase Benzonase peut être séparée du produit cible par chromatographie. Cependant, en raison de la nature résistante de cette endonucléase, nous recommandons de ne pas utiliser Benzonase si un produit final exempt de nucléases est requis.
Pourquoi l'endonucléase Benzonase® ne fonctionne-t-elle pas ? Qu'est-ce qui inhibe son activité ?
L'endonucléase Benzonase® est active dans un large éventail de conditions de fonctionnement (voir le paragraphe sur les caractéristiques de l'enzyme). Cependant, une concentration de 1 à 2 mM de Mg2+ est indispensable à l'activité de l'endonucléase Benzonase®.
Le Mn2+ peut se substituer au Mg2+. Néanmoins, l'enzyme n'atteindra son activité optimale qu'en présence de Mg2+. La nucléase est inhibée (environ 50 % d'activité) par des concentrations en cations monovalents > 300 mM, des concentrations en phosphate > 100 mM et des concentrations en sulfate d'ammonium > 100 mM. En outre, des concentrations > 1 mM d'EDTA inhiberont l'activité de l'endonucléase Benzonase®.
J'observe une perte d'activité. Pour quelles raisons ?
En règle générale, l'endonucléase Benzonase® est très stable. Toutefois, une perte d'activité peut être observée dans de rares cas. Plusieurs raisons peuvent expliquer ce phénomène : l'inactivation irréversible peut être due à la présence d'agents dénaturants dans l'échantillon, comme des protéases, ou à une conservation incorrecte du produit. L'inactivation réversible est généralement due à la présence d'agents chélateurs, tels que de l'EDTA, qui élimine les ions magnésium essentiels.
Comment éliminer l'endonucléase Benzonase® dans un modèle de bioprocessing ?
Plusieurs étapes en aval peuvent éliminer l'endonucléase Benzonase®, comme la filtration en profondeur pour la clarification, la filtration à flux tangentiel (TFF) pour la concentration, la diafiltration et la chromatographie (IEX, SEC, HIC). Consultez le Chapitre 2 consacré à l'élimination de l'endonucléase Benzonase® (page 36 de l'Annexe) pour de plus amples informations.
STABILITÉ ET CONDITIONS DE FONCTIONNEMENT
J'ai oublié endonucléase Benzonase® sur la paillasse. Ma nucléase est-elle encore fonctionnelle ?
Nous avons réalisé des tests de stabilité approfondis sur l'endonucléase Benzonase® et le produit s'avère extrêmement stable. Même soumise à des incubations prolongées à 37 °C, l'endonucléase Benzonase® a conservé > 90 % de son activité pendant plusieurs mois.
Je souhaite utiliser un tampon différent. Quelles sont les conditions absolument indispensables pour garantir une activité maximale de l'endonucléase Benzonase® ? Qu'est-ce qui son activité ?
Pour garantir son activité, l'endonucléase Benzonase® a besoin de 1 à 2 mM de Mg2+. La nucléase est inhibée (environ 50 % d'activité) par des concentrations en cations monovalents > 50 %, des concentrations en phosphate > 20 mM et des concentrations en sulfate d'ammonium > 25 mM.
Quelle quantité supplémentaire d'endonucléase Benzonase® dois-je ajouter si je travaille à basse température ?
Pour garantir son activité, l'endonucléase Benzonase® a besoin de 1 à 2 mM de Mg2+. La nucléase est inhibée (environ 50 % d'activité) par des concentrations en cations monovalents > 50 %, des concentrations en phosphate > 20 mM et des concentrations en sulfate d'ammonium > 25 mM.
APPLICATIONS D'EXTRACTION DES PROTÉINES
L'endonucléase Benzonase® est-elle compatible avec des cocktails d'inhibiteurs de protéases ?
Oui. Cependant, la prudence est de mise puisque de nombreux cocktails d'inhibiteurs de protéases comprennent de l'EDTA. Or, des concentrations supérieures à 1 mM d'EDTA inhiberont l'activité de l'endonucléase Benzonase®.
Ma protéine est insoluble et je dois effectuer une purification dans des conditions dénaturantes. L'endonucléase Benzonase® fonctionnera-t-elle encore dans l'urée ?
En fait, l'activité de l'endonucléase Benzonase® augmente en présence d'urée à des concentrations allant jusqu'à 6 M. À 6 M d'urée, l'activité enzymatique commence par augmenter, avant de diminuer au fil du temps. À 7 M d'urée, l'endonucléase Benzonase® se dénature après 15 minutes, et perd son activité. Cependant, les acides nucléiques sont fortement dégradés avant l'inactivation. Des concentrations initiales plus élevées en endonucléase Benzonase® peuvent partiellement compenser les effets des 7 M d'urée.
Pourquoi tant de variétés d'endonucléases Benzonase® ? Que signifie HC ? Quel est l'impact d'une pureté de 90 % par rapport à une pureté de 99 % ?
Pour répondre au plus large éventail possible d'exigences en matière de procédés et de coûts, les endonucléases Benzonase® sont disponibles dans deux degrés de pureté différents : Degré de pureté I (> 99 %) et degré de pureté II (> 90 %). Les deux degrés sont disponibles à 25 U/μl ou à une concentration plus élevée (HC, pour high concentration), définie à 250 U/μl. Pour les achats en grandes quantités, contactez le Service Clients.
Pour obtenir la liste complète des produits Benzonase® et pour connaître leurs différences, consultez notre page consacrée aux endonucléases.
Quel est le résultat final de la dégradation totale de l'acide nucléique par l'endonucléase Benzonase® ?
L'endonucléase Benzonase® digère complètement les acides nucléiques en oligonucléotides à terminaison 5'-monophosphate d'une longueur de 2 à 5 bases.
APPLICATIONS DE BIOPRODUCTION
Comment déterminer la qualité/quantité d'endonucléase Benzonase® adéquate pour une application donnée ?
Plusieurs paramètres influent sur l'activité de l'endonucléase Benzonase®. Les conditions optimales varient donc d'un procédé à l'autre et doivent être déterminées de manière expérimentale. Pour réduire la viscosité, une endonucléase Benzonase® avec un degré de pureté II (≥ 90 %) suffira dans la plupart des cas. Dans des conditions d'essai standards, une unité d'endonucléase Benzonase®correspond environ à la quantité d'enzyme nécessaire pour assurer la digestion complète de 37 µg d'ADN en 30 minutes.
À quelle étape de mon procédé dois-je introduire l'endonucléase Benzonase® ?
La réponse à cette question dépend de la raison pour laquelle vous utilisez une endonucléase Benzonase®. Les exemples d'applications présentés vous aideront certainement à répondre à cette question. Toutefois, en règle générale, l'endonucléase Benzonase® fonctionne mieux lorsqu'elle est ajoutée après la culture et avant l'étape de capture.
L'endonucléase Benzonase® est-elle sûre ?
Oui, des études toxicologiques ont été menées sur l'endonucléase Benzonase® (des rapports internes sont disponibles). Dans ces études, la toxicité systémique après une application unique a été examinée chez la souris et le rat : aucun effet toxique n'a été observé, même à très fortes doses. Par ailleurs, aucun potentiel mutagène n'a été constaté chez les souris traitées par voie intraveineuse, même à des doses d'endonucléase Benzonase® élevées.
Pourquoi le volume de la plage de remplissage des tubes de 5 millions d'unités n'est-il pas spécifié ?
Comme l'activité (U/ml) de l'endonucléase Benzonase® est susceptible de varier entre les lots de production, nous avons choisi de spécifier les unités par tube, mais pas le volume. Le calcul du volume par tube peut être réalisé facilement à partir des informations d'activité présentes sur le Certificat d'analyse (CoA).
ENDONUCLÉASE TOLÉRANTE AU SEL BENZONASE®
La séquence est-elle similaire à celle des anciens produits Benzonase®, comme Benzonase® Safety Plus ?
L'endonucléase tolérante au sel Benzonase® est une toute nouvelle enzyme conçue grâce à une ingénierie des protéines de pointe pour garantir une activité maximale à une salinité élevée. Sa séquence d'acides aminés est différente de celles des autres produits Benzonase® existants.
Quels éléments diffèrent par rapport aux conditions d'utilisation des anciens produits Benzonase® ?
L'endonucléase tolérante au sel Benzonase® fonctionne dans les mêmes conditions que les produits Benzonase® existants. Seule la concentration en cations monovalents, pour laquelle nous recommandons au minimum 300 mM de NaCl, fait exception.
Comment inhiber cette enzyme ?
L'ajout d'EDTA ou l'exposition à la chaleur permet d'inhiber cette enzyme.
Comment éliminer cette enzyme ?
Consultez la rubrique "Comment éliminer l'endonucléase Benzonase® dans un modèle de bioprocessing ?" ci-dessus.
Comment détecter des traces de cette enzyme ?
Pour notre enzyme Benzonase® existante, un kit ELISA dédié complète notre offre afin de garantir une détection fiable de l'endonucléase tolérante au sel Benzonase®.
Pourquoi utiliser cette enzyme plutôt que d'autres nucléases standards ?
Toutes les nucléases standards disponibles sur le marché et utilisées pour les bioprocédés se basent sur une séquence d'acides aminés très similaire. Cela signifie que leur capacité à digérer les acides nucléiques à haute salinité est comparable, et considérée comme sous-optimale.
Les conditions de fonctionnement efficaces concernant les plages de concentrations en cations monovalents se situent entre 0 et 200 mM. Soit des valeurs similaires aux concentrations physiologiques en sel présentes dans les procédés biologiques.
Parallèlement, il a été démontré que l'utilisation d'une salinité plus élevée, supérieure à la concentration physiologique, pendant la lyse des cellules HEK, a une réelle incidence sur le rendement global du procédé. À des concentrations de 500 mM de NaCl, l'infectivité et le taux de récupération des AAV sont significativement plus élevés qu'à une concentration en sel de 150 mM.
Le recours à une nucléase tolérante au sel est alors nécessaire afin d'éliminer l'acide nucléique dans ces conditions de forte salinité.
Puis-je toujours utiliser des nucléases ordinaires à des concentrations en sel > 200 mM ?
L'activité des nucléases ordinaires à des concentrations en sel supérieures à la concentration physiologique sera considérablement réduite, d'où la nécessité d'ajouter d'autres enzymes et une complexification du procédé de purification du médicament. Il en résulte également un procédé peu rentable et des coûts de possession plus élevés. Pour les raisons évoquées ci-dessus, nous recommandons donc l'utilisation d'une nucléase tolérante au sel.
Puis-je utiliser des kits de détection d'autres fournisseurs pour détecter l'endonucléase tolérante au sel Benzonase® ? Notamment d'autres kits spécialisés pour d'autres nucléases tolérantes au sel ?
L'endonucléase tolérante au sel Benzonase® est une toute nouvelle enzyme. Aucun kit commercialisé n'est capable de la détecter à l'exception de nos propres kits.
Remarque : tout produit non vendu via un canal Merck officiel sur lequel apparaît le nom commercial "Benzonase®" doit être considéré comme un produit contrefait.
Pourquoi l'hôte d'expression est-il si important pour la production d'enzymes ?
Plusieurs plateformes de production permettent d'obtenir une expression protéique. Les expressions à base de levures et de bactéries sont les plus courantes. Cependant, les produits finaux obtenus ne sont pas similaires et les profils de modification post-traductionnelle sont différents selon la plateforme utilisée.
Les protéines exprimées dans la levure sont fortement glycosylées et modifiées, ce qui peut entraîner divers problèmes lors de l'utilisation du produit, notamment une précision de détection médiocre lors des dosages d'anticorps.
La principale endonucléase tolérante au sel disponible sur le marché est exprimée dans la levure.
Pourquoi les modifications post-traductionnelles des nucléases peuvent avoir une incidence sur la précision et l'efficacité de la détection ?
Les protéines glycosylées présentent un profil non homogène (tel qu'illustré à la Figure 2), non reproductible d'un lot à l'autre. Étant donné que les méthodes de détection standards utilisent des immunodosages, les anticorps générés pour détecter la protéine d'intérêt ne peuvent couvrir tout le spectre des modifications observées lors de l'expression dans la levure. Il en résulte une précision de détection médiocre des méthodes basées sur les anticorps, comme les kits ELISA.
Quel est le profil toxicologique de cette enzyme ?
Le profil toxicologique de l'endonucléase tolérante au sel Benzonase® est similaire à celui des autres produits de la gamme Benzonase®.
Pouvez-vous m'aider à définir quelle nucléase serait la plus rentable pour mon procédé ? Tout en gardant à l'esprit l'efficacité et le rendement globaux du procédé.
Nous proposons une gamme complète de nucléases destinées à répondre à vos besoins réglementaires et aux exigences de vos procédés. N'hésitez pas à solliciter notre service d'assistance MSAT (Manufacturing Science And Technology) pour développer votre procédé. Nos experts couvrent l'ensemble des modèles de fabrication, depuis l'Upstream jusqu'au remplissage final.
FAQ Deviron®
Puis-je continuer d'utiliser le TRITON™ X-100 si je ne réside pas dans un pays de l'Union européenne ?
L'interdiction du TRITON™ X-100 a été actée par l'ECHA1, au titre du règlement REACH2. Cette interdiction est principalement motivée par la haute toxicité du produit pour la santé humaine et pour l'environnement. Par conséquent, le retrait de ce produit de la bioproduction est actuellement l'une des évolutions les plus importantes du secteur. Des agences réglementaires hors UE vont également évaluer l'utilisation du produit, ce qui devrait conduire à des interdictions ultérieures.
Pourquoi ne puis-je pas utiliser un détergent de qualité recherche pour la bioproduction ?
En règle générale, les détergents sont fabriqués dans des volumes gigantesques, avec des réactions de chimie organique en chaîne. Parfois, dans un souci d'économie de coûts de production, les matières premières utilisées sont de qualité médiocre. Cette stratégie entraîne des impuretés très dangereuses dans les produits de la décomposition, comme les dioxines ou les nitrosamines. Ces détergents de qualité recherche ne sont utilisés que pour des applications de nettoyage et ne doivent pas côtoyer une préparation médicamenteuse.
Quelles sont les principales étapes pour passer au Deviron® ?
La gamme Deviron® compte 3 lots de produits fabriqués selon les BPF EXCiPACT. Il est déjà possible de demander des échantillons de ces lots à des fins de qualification. Les dossiers Emprove® qui accompagnent nos produits contiennent toutes les informations nécessaires aux autorités réglementaires. Des informations toxicologiques sont également disponibles.
Je souhaiterais tester le Deviron®, mais je ne connais pas ce produit. Quelle aide pouvez-vous m'apporter ?
Pour tout ce qui a trait aux applications, notre équipe d'experts en biofabrication se tient à votre disposition pour vous guider dans ce changement. Contactez votre interlocuteur Merck pour obtenir une assistance technique gratuite.
Quelle est la différence entre MQ400/Emprove® Evolve et MQ500/Emprove® Expert (BPF) ?
Pour vous aider dans votre soumission de dossier réglementaire, nous avons créé différents programmes de documentation et de qualité pour faciliter l'identification du produit adapté à votre application. Cliquez sur les liens suivants pour en savoir plus sur les programmes Emprove® et M-Clarity®. Les niveaux de qualité Deviron® C16 Emprove® Evolve et Deviron® 13-S9 Emprove® Expert comptent parmi les plus élevés que nous proposons.
Quelles sont les concentrations recommandées pour les applications cibles ?
Pour l'inactivation virale, la norme ASTM3 E3042-16 utilisée pour le TRITON™ X-100 reste à ce jour le document de référence pour la fabrication d'anticorps monoclonaux. Les concentrations employées dans le secteur varient de 0,5 à 1 % selon l'application.
Pour les applications de lyse cellulaire, un large éventail de concentrations est utilisé, toutes spécifiques au procédé. Nous recommandons d'essayer différentes concentrations en parallèle lors du développement du procédé. Nos détergents Deviron® sont au moins aussi efficaces que le TRITON™ X-100 ou les polysorbates.
Pouvons-nous développer une méthode de détection conforme aux BPF pour le Deviron® ?
Nos experts de R&D ont développé des méthodes de détection pour notre gamme Deviron®, que nous pouvons communiquer à nos clients. Cependant, pour les méthodes de détection conformes aux BPF, notre laboratoire BioReliance® reste le partenaire privilégié. N'hésitez pas à nous contacter pour toute question.
La gamme Deviron® est-elle compatible avec Benzonase® pour les applications de lyse cellulaire ?
Benzonase® est la méthode de référence pour la digestion de l'ADN dans les procédés AAV4. La gamme Deviron® a été développée pour être totalement compatible avec les endonucléases Benzonase®. L'utilisation combinée de ces deux gammes n'entraîne aucune perte d'activité enzymatique ni de propriété détergente. Vous trouverez les données d'application dans la brochure de la gamme Deviron®.
Quelle est la capacité de production de la gamme Deviron® ?
La gamme Deviron® provient de notre site de Darmstadt en Allemagne. Nous pouvons d'ores et déjà proposer plus de 100 tonnes de produit chaque année. N'hésitez pas à nous faire part de vos prévisions afin que nous puissions planifier au mieux des délais d'exécution spécifiques.
1European Chemicals Agency (Agence européenne des produits chimiques)
2Registration, Evaluation, Authorization and Restriction of Chemicals* (Enregistrement, évaluation, autorisation et restriction des produits chimiques)
3American Standard for Test Method (Norme américaine pour les méthodes de test)
4Virus adéno-associé
TRITON est une marque commerciale de The Dow Chemical Company ("Dow") ou une filiale de Dow sous licence.
Références bibliographiques
Nous fournissons à nos clients des informations et des conseils au mieux de nos connaissances et compétences, mais sans obligation ni responsabilité. Les lois et réglementations existantes doivent dans tous les cas être respectées par nos clients. Cela s'applique également au respect des droits de tiers. Nos informations et nos conseils ne dispensent pas nos clients de leur propre responsabilité de vérifier l'adéquation de nos produits avec l'utilisation envisagée.
Pour continuer à lire, veuillez vous connecter à votre compte ou en créer un.
Vous n'avez pas de compte ?