Evaluación de los filtros de jeringa Millex® para analizar las impurezas nitrosamínicas en productos farmacéuticos
Análisis de las impurezas nitrosamínicas
La detección y la cuantificación de las nitrosaminas en las medicinas es esencial para garantizar la inocuidad y la calidad de los productos farmacéuticos. En los procesos sintéticos se introducen impurezas químicas nitrosamínicas a través de múltiples rutas difíciles de predecir y se sospecha que tienen propiedades carcinógenas y genotóxicas, lo que plantea un riesgo para la salud del paciente.1-4 Se han detectado en principios activos y excipientes, lo que ha provocado la retirada de muchos productos desde 2018, entre ellos el valsartán.5,6
Requisitos normativos para el análisis de nitrosaminas
Las autoridades sanitarias , como la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA), la Agencia Europea de Medicamentos (EMA) y el Consejo Internacional para la Armonización de los Requisitos Técnicos para el registro de los medicamentos para Uso Humano (ICH), han proporcionado directrices y requisitos relativos a las nitrosaminas en los productos farmacéuticos. En la Tabla 1 se muestra un resumen de sus puntos clave.
Estas autoridades normativas supervisan y actualizan activamente sus directrices relativas a las nitrosaminas para garantizar la salud y la seguridad públicas. Es importante que los fabricantes farmacéuticos se adhieran a estas directrices y requisitos mientras evalúan y mitigan el riesgo de contaminación con nitrosaminas de los medicamentos.
Métodos analíticos para el análisis de nitrosaminas
Las autoridades sanitarias globales, como la EMA, la FDA de los Estados Unidos y otras, han enfatizado la importancia de disponer de métodos analíticos robustos para el análisis de nitrosaminas en los productos farmacéuticos. La LC-MS/MS es un método analítico comúnmente recomendado por todas las autoridades sanitarias para el análisis de nitrosaminas. La combinación de separación mediante cromatografía de líquidos de alto rendimiento (HPLC) con detección por espectrometría de masas en tándem (MS/MS) permite una gran sensibilidad, selectividad y precisión. La LC-MS/MS es capaz de detectar y cuantificar concentraciones traza de las diversas nitrosaminas en matrices de muestras complejas, lo que hace que sea adecuada para el análisis sistemático y la adhesión a los límites normativos. El procedimiento 3 de la USP <1469> utiliza LC-MS/MS para la cuantificación de las nitrosaminas.13 La FDA de los Estados Unidos, la Farmacopea Europea,14 la Health Sciences Agency (HSA) de Singapur,15 y la Administración de Alimentos y Medicamentos de Taiwán16 también han publicado métodos de LC-MS/MS para la determinación de nitrosaminas en la ranitidina y otros medicamentos.
La HPLC acoplada a la espectrometría de masas de alta resolución (HPLC-HRMS o LC-HRMS) es otra técnica fundamental para el análisis de nitrosaminas. La selectividad de este método ha permitido diferenciar las impurezas nitrosaminoides de las nitrosaminas reales, asegurando la fiabilidad de los resultados analíticos. La FDA ha desarrollado y validado los métodos LC-HRMS,17, que se describen también en el procedimiento 1 de la USP <1469>.
También se utiliza la HPLC con detección UV/Vis para el análisis de las nitrosaminas. Si bien puede tener una sensibilidad más baja en comparación con la LC-MS/MS, puede usarse como un método rápido para el análisis de materias primas, disolventes o excipientes. La Agence Nationale de Sécurité du Médicament et des Produits de Santé (ANSM) tiene dos métodos basados en HPLC-UV.18,19
La combinación de cromatografía de gases-espectrometría de masas en tándem (GC-MS/MS) es otro método comúnmente utilizado para el análisis de las nitrosaminas. Ofrece una excelente sensibilidad y especificidad para la detección de nitrosaminas y es particularmente útil para las nitrosaminas volátiles. La USP <1469>,10 la FDA taiwanesa,13 y Swissmedic20 utilizan métodos de GC-MS/MS para los análisis de nitrosaminas, y la Health Sciences Agency (HSA) de Singapur publicó un método basado en la combinación de cromatografía de gases de masa precisa y alta resolución y espectroscopía de masas (HRAM-GCMS).21
Requisitos de filtración de las muestras para el análisis de nitrosaminas
La mayoría de los métodos antes mencionados exigen la filtración de las muestras antes de la inyección. La filtración es la forma más sencilla de eliminar las partículas de las muestras y las fases móviles antes de la inyección, las cuales podrían afectar significativamente el rendimiento de un equipo de HPLC. Las partículas son muy comunes en productos farmacéuticos como el valsartán en los que aparecen como consecuencia del proceso de disolución de la formulación. El tamaño de poro de una membrana de filtración determina en qué medida puede retener las partículas de una muestra; 0,45 µm es común en los métodos de HPLC. Cuando se utilizan columnas rellenas de partículas pequeñas (por ejemplo, partículas por debajo de 2 µm) y cuando se utiliza UHPLC, se recomienda un filtro de 0,2 μm. Es importante observar que membranas de filtración con el mismo tamaño de poro de retención no siempre tienen la misma eficiencia de retención, como se demostró en un estudio anterior.22
En la Tabla 2 se enumeran las etapas de filtración en métodos específicos publicados por las autoridades sanitarias de todo el mundo. En el caso de los métodos analíticos para las nitrosaminas, los filtros de jeringa son el formato preferido. Dos atributos importantes de los filtros de jeringa que entran en juego son el material de la membrana de filtración y el tamaño de los poros. El PVDF y la PTFE son los materiales filtrantes que se mencionan más a menudo en los métodos analíticos publicados; en algunos casos también se mencionan el nailon y el polipropileno hidrófilo (por ejemplo, la membrana de GHP) (Tabla 2). Los tamaños de poro en los métodos son de 0,2, 0,22 y 0,45 μm.
Métodos experimentales
En este estudio se utilizó un método de la USP < 1469> Procedimiento 3 previamente validado.31La Parte 1 es un estudio sobre las impurezas nitrosamínicas extraíbles de los filtros de jeringa y la Parte 2 es un estudio de recuperación utilizando valsartán enriquecido. En la Tabla 3 se muestran las condiciones de LC-MS/MS y en la Tabla 4 las transiciones MRM
Filtros de jeringa probados. Se probaron tres unidades de cada uno de dos lotes de (1) Millex® PVDF 0,22 µm y (2) Millex® PTFE 0,2 µm y tres unidades de cada lote de (3) Proveedor P PVDF 0,2 µm, (4) Proveedor C H-PTFE 0,2 µm, (5) Proveedor M PVDF 0,2 µm, y (6) Proveedor M PTFE 0,2 µm.
Parte 1 - Extraíbles. Para determinar si había niveles basales de impurezas nitrosamínicas extraíbles en los filtros de jeringa, se enriqueció una muestra de diluyente solo (ácido fórmico al 0,1 % v/v en agua) con cuatro patrones internos marcados isotópicamente (IS) según la USP <1469> [10 µg/ml para NDMA-d6 y NMBA-d3 y 1 µg/ml para NDEA-d10/NDBA-d18]. Las muestras se agitaron en Vórtex, se centrifugaron (10.000 rpm durante 10 min) y el sobrenadante se filtró utilizando filtros de jeringa de 13 mm. Se analizó la presencia de seis compuestos nitrosamínicos en el filtrado utilizando LC-MS/MS. Las concentraciones se determinaron utilizando una curva de calibración externa de 1,33 - 90 ng/ml (NDMA, NMBA, NEIPA, NDIPA y NDBA) y 0,66-69,4 ng/ml (NDEA).
Parte 2 - Recuperación. Se pulverizaron 40 mg de valsartán dura (dosis de 80 mg), se diluyeron con ácido fórmico al 1 % en agua y se enriquecieron a una concentración baja (L2) según USP <1469>. A continuación la muestra se centrifugó, filtró y analizó mediante LC-MS/MS.
Evaluación de los filtros para análisis de nitrosaminas
La filtración de las muestras antes de su inyección forma parte de muchos métodos basados en LC-MS y GC-MS para el análisis de las impurezas nitrosamínicas. Garantizar la ausencia de extraíbles en las unidades de filtración es fundamental para mantener la precisión y la uniformidad de los datos en estos métodos. Además, es esencial realizar estudios de recuperación, ya que ciertas moléculas tienen el potencial de unirse a los componentes de un filtro de jeringa y por lo tanto pueden afectar a la calidad de los datos generados.
Se utilizó un método validado basado en el procedimiento 3 de la USP <1469> para evaluar los filtros de jeringa.27 Este método de la USP describe el uso de LC-MS/MS para la cuantificación de NDMA, NDEA, NDIPA, NEIPA, NMBA, y NDBA en sartanes seleccionados (valsartán, losartán potásico, olmesartán medoxomilo, candesartán cilexetilo y telmisartán). La última parte de la subsección “Disolución de la muestra” del método requiere filtración “utilizando un filtro hidrófilo de politetrafluoroetileno (PTFE) de 0,45 μm de tamaño de poro” después de la centrifugación.11
Parte 1 – Extraíbles
Se analizaron los extraíbles nitrosamínicos del filtrado obtenido en la etapa de filtración por jeringa utilizando una curva de calibración externa de 1,33-90 ng/ml (NDMA, NMBA, NEIPA, NDIPA y NDBA) y 0,66-69,4 ng/ml (NDEA). La Figura 1 es un ejemplo de cromatograma MRM de estos compuestos.
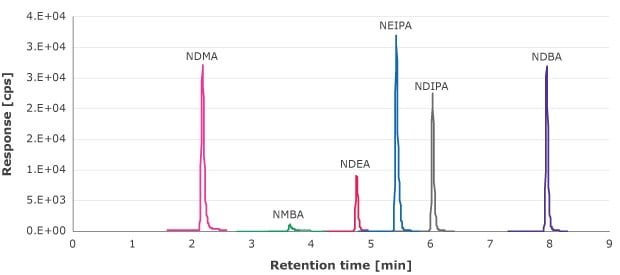
Figura 1.Cromatograma en modo MRM de las disoluciones patrón de nitrosamina. (10 ng/ml para NDMA, NMBA, NEIPA, NDIPA y NDBA y 6,6 ng/ml para NDEA)
El límite de cuantificación (LOQ) se define como la concentración que da cociente S/N de 10. La menor concentración de las curvas de calibración para cada impureza nitrosamínica analizada tenía un S/N >10. No se detectó nitrosamina a este valor o por encima en ninguno de los filtros de jeringa probados (Tabla 5).
ABREVIATURAS: S/N = cociente señal-ruido; PVDF = fluoruro de poli(vinilideno) hidrófilo; PTFE = politetrafluoretileno hidrófilo; LOQ = límite de cuantificación; ND = no detectado
Es fundamental garantizar que las unidades de filtración no tengan extraíbles químicos que puedan afectar negativamente a la calidad de los datos, en especial con métodos en los que se utilizan equipos de gran sensibilidad. Los extraíbles deben evitarse porque pueden co-eluir con los picos de analito o aparecer como picos inesperados en análisis posteriores, lo que dificultará la interpretación de los datos. Los extraíbles podrían proceder del desprendimiento del filtro, los productos químicos residuales del proceso de fabricación o de productos químicos secundarios lavados del filtro. En el caso de analitos específicos como los compuestos de nitrosamina, los extraíbles podrían formularse accidentalmente durante el proceso de preparación de la membrana.
Parte 2 - Recuperación en el valsartán
El estudio de recuperación se realizó enriqueciendo la muestra de valsartán con patrones de referencia a un nivel de concentración baja (L2). Se analizaron disoluciones preparadas de la muestra mediante LC-MS/MS, utilizando una curva de calibración externa para calcular la concentración de cada analito. Se determinó el cociente entre señal del patrón interno y la señal del analito (por ejemplo, señal para NDMA-D6 / señal para NDMA) en la disolución de muestra y en las disoluciones de calibración externas.
En la Tabla 6 se muestra la recuperación media para los filtros de jeringa de PVDF y PTFE probados. Las recuperaciones de todos los compuestos estaban dentro de un intervalo aceptable del 70 al 130 %31 para todos los dispositivos y materiales probados, con algunas diferencias menores observadas entre compuestos y material filtrante. Por ejemplo, la NDBA demostró recuperaciones comparativamente bajas (aunque dentro del intervalo aceptable), debido posiblemente a sus interacciones hidrófobas con los medios de filtración o los principios del producto farmacéutico. Los dos filtros de jeringa hidrófilos, de PVDF y PTFE, Millex®demostraron recuperaciones constantes de lote a lote.
La unión de moléculas de analito al dispositivo de filtración es otro factor a considerar al elegir los materiales del filtro de jeringa, ya que la adsorción podría provocar recuperaciones pobres. Las propiedades físico-químicas del dispositivo de filtración (la membrana de filtración y la carcasa) y la química del analito dictan el grado de unión. Varias interacciones secundarias, como las interacciones electrostáticas, los enlaces de hidrógeno y las interacciones hidrófobas, contribuyen a la adsorción del analito a la membrana de filtración y la carcasa del filtro.32 En este estudio, las recuperaciones relativamente menores de NDMA utilizando membranas de filtración de PVDF y PTFE (aunque dentro del intervalo aceptable) podrían ser consecuencia de interacciones hidrófobas entre la NDMA y la membrana. La NDIPA tuvo recuperaciones menores con las membranas de PVDF, lo que indica que es posible que la molécula interaccione de manera diferente con los polímeros de PTFE que con los de PVDF. Otros polímeros con grupos funcionales polares y mayores tendencias de unión inespecíficas, como el nailon, demostrarían probablemente una adsorción mayor y, por lo tanto, mayores pérdidas de analitos. Para obtener las recuperaciones más precisas, se sugiere descartar los primeros ml de filtrado durante la preparación de la muestra, como se recomienda en los métodos de la FDA de los Estados Unidos para el análisis de nitrosaminas.23,24 Así se garantiza la saturación de los sitios de unión con el analito y, por tanto, la ausencia de pérdidas añadidas de analito. Hemos observado este fenómeno incluso en materiales de membrana de gran adsorción como el nailon.
Ensayos de impurezas nitrosamínicas y selección de filtros
Todos los filtros de jeringa de PVDF y PTFE probados demostraron concentraciones de extraíbles nitrosamínicos por debajo del límite de cuantificación según el procedimiento 3 de la USP <1469>. Además, todos dieron recuperaciones aceptables de analitos enriquecidos de nitrosamina, mostrando solo diferencias menores para compuestos diferentes. Esto demuestra la idoneidad de estos medios filtrantes para su utilización en la preparación de las muestras para los métodos analíticos de las nitrosaminas.
Aplicaciones relacionadas
- Análisis y control de calidad (QC) de moléculas pequeñas
Un análisis y un control de calidad (QC) de las moléculas pequeñas que cumplan las especificaciones de las farmacopeas internacionales es fundamental en el desarrollo de fármacos. La química analítica y los análisis microbiológicos garantizan que las moléculas pequeñas se desarrollan y fabrican siguiendo las buenas prácticas de fabricación (GMP).
- Pruebas de referencia y orientación normativa
Las pruebas de referencia son esenciales para excipientes y la liberación de especialidades farmacéuticas. Las farmacopeas internacionales como la USP y el EP han establecido normas de calidad. Las pruebas y el cumplimiento de estas normas detalladas en los métodos de referencia constituyen un requisito básico para los ingredientes y las especialidades farmacéuticos.
Referencias bibliográficas
Para seguir leyendo, inicie sesión o cree una cuenta.
¿No tiene una cuenta?