MAB1562
Anticuerpo anti-proteína priónica, aa 109-112, clon 3F4
clone 3F4, Chemicon®, from mouse
Sinónimos:
PrP, CD230
About This Item
Productos recomendados
origen biológico
mouse
Nivel de calidad
forma del anticuerpo
purified immunoglobulin
tipo de anticuerpo
primary antibodies
clon
3F4, monoclonal
reactividad de especies
hamster, human
fabricante / nombre comercial
Chemicon®
técnicas
ELISA: suitable
immunohistochemistry (formalin-fixed, paraffin-embedded sections): suitable
immunoprecipitation (IP): suitable
western blot: suitable
isotipo
IgG2a
Nº de acceso NCBI
Nº de acceso UniProt
Condiciones de envío
dry ice
modificación del objetivo postraduccional
unmodified
Información sobre el gen
human ... PRNP(5621)
Descripción general
Especificidad
Inmunógeno
Aplicación
Imágenes representativas de un lote anterior. Tinción óptima con tampón citrato, pH 6,0, Recuperación del epítopo: Cerebro humano
Inmunohistoquímica (Kitamoto et al., 1987):
1:100-1:1 000 *Véase el protocolo más adelante.
El epítopo debe re-exponerse en el tejido fijado mediante pretratamiento del tejido utilizando uno de los siguientes procedimientos:
a. ácido fórmico durante 10 minutos a temperatura ambiente (Kitamoto et al., 1987)
b. autoclave hidrolítico (Kitamoto et al., 1991)
c. tratamiento en microondas (BioGenex, San Ramon, CA)
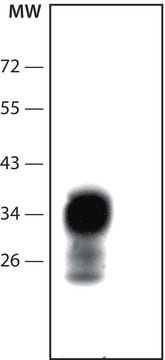
Inmunoelectrotransferencia (western blot): (Kascsak, R.J., 1991; Kascsak, R.J., 1987):
Se utilizó una dilución 1:10 000 - 1:100 000 de un lote anterior.
Inmunoprecipitación: (Kascsak, R.J., 1991; Kascsak, R.J., 1987):
se utilizó una dilución 1:10 -1:100 de un lote anterior.
ELISA: (Kascsak, R.J., 1991; Kascsak, R.J., 1987):
se utilizó una dilución 1:100 000 de un lote anterior.
Las diluciones de trabajo óptimas deben ser determinados por el usuario final.
Calidad
Proteína priónica (nº de ref. MAB377) en cerebro sano. El tejido fue pretratado con citrato, pH 6,0. Este lote de anticuerpo fue diluido 1:500, utilizando detección IHC-Select con HRP-DAB. La inmunorreactividad se observa predominantemente como tinción de los cuerpos celulares de las neuronas.
Tinción óptima con tampón citrato, pH 6,0, Recuperación del epítopo: Cerebro humano
Descripción de destino
Forma física
Información legal
Not finding the right product?
Try our Herramienta de selección de productos.
Código de clase de almacenamiento
12 - Non Combustible Liquids
Clase de riesgo para el agua (WGK)
WGK 2
Punto de inflamabilidad (°F)
Not applicable
Punto de inflamabilidad (°C)
Not applicable
Certificados de análisis (COA)
Busque Certificados de análisis (COA) introduciendo el número de lote del producto. Los números de lote se encuentran en la etiqueta del producto después de las palabras «Lot» o «Batch»
¿Ya tiene este producto?
Encuentre la documentación para los productos que ha comprado recientemente en la Biblioteca de documentos.
Nuestro equipo de científicos tiene experiencia en todas las áreas de investigación: Ciencias de la vida, Ciencia de los materiales, Síntesis química, Cromatografía, Analítica y muchas otras.
Póngase en contacto con el Servicio técnico