Bewertung von Millex®-Spritzenvorsatzfiltern zur Prüfung auf Nitrosaminverunreinigungen in pharmazeutischen Erzeugnissen
Prüfung auf Nitrosaminverunreinigungen
Der Nachweis und die Quantifizierung von Nitrosaminen in Arzneimitteln ist von entscheidender Bedeutung, um die Sicherheit und Qualität pharmazeutischer Produkte zu gewährleisten. Chemische Verunreinigungen durch Nitrosamine werden in Syntheseprozessen über mehrere und schwer vorhersehbare Wege eingebracht und stehen unter Verdacht, karzinogene und genotoxische Eigenschaften zu haben. Daher stellen sie ein Risiko für die Gesundheit der Patienten dar.1-4 Nitrosamine wurden in Wirkstoffen und Hilfsstoffen nachgewiesen und haben seit 2018 zu zahlreichen Rückrufaktionen geführt, von denen unter anderem Valsartan betroffen war.5,6
Regulatorische Anforderungen für die Nitrosaminanalyse
Arzneimittelbehörden und Organisationen wie die US-amerikanische Food and Drug Administration (FDA), die Europäische Arzneimittel-Agentur (EMA) und der International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH) haben Richtlinien und Anforderungen bezüglich Nitrosaminen in pharmazeutischen Produkten herausgegeben. Eine Zusammenfassung der wichtigsten Punkte ist in Tabelle 1 aufgeführt.
Diese Regulierungsbehörden überwachen die Entwicklungen in Bezug auf Nitrosaminverunreinigungen aktiv und aktualisieren ihre Leitlinien entsprechend, um die öffentliche Gesundheit und Sicherheit zu gewährleisten. Für pharmazeutische Hersteller ist es wichtig, diese Richtlinien und Anforderungen einzuhalten, während sie das Risiko von Nitrosaminverunreinigungen in Arzneimitteln bewerten und mindern.
Methoden für die Nitrosaminanalyse
Internationale Zulassungsbehörden wie die EMA und FDA betonen die Bedeutung robuster Analysemethoden bei der Prüfung von Arzneimitteln auf Nitrosamine. LC-MS/MS ist eine allgemein empfohlene Analysemethode für die Nitrosaminanalyse, die von allen Regulierungsbehörden eingesetzt wird. Die Kombination einer Trennung mittels Hochleistungsflüssigkeitschromatographie (HPLC) und nachgeschalteter Detektion mittels Tandem-Massenspektrometrie (MS/MS) ermöglicht eine hohe Empfindlichkeit (Sensitivität), Selektivität und Genauigkeit. Mit LC-MS/MS können Spurenkonzentrationen der verschiedenen Nitrosamine in komplexen Probenmatrizen nachgewiesen und quantifiziert werden. Die Resultate können dann routinemäßig analysiert werden, um die Einhaltung gesetzlicher Grenzwerte sicherzustellen. In Verfahren 3 von USP <1469> wird LC-MS/MS zur Quantifizierung von Nitrosaminen verwendet.13 Die US-amerikanische FDA, das Europäische Arzneibuch,14 die Health Sciences Agency (HSA) von Singapur,15 und die Taiwan Food and Drug Administration16 haben ebenfalls LC-MS/MS-Methoden zur Bestimmung von Nitrosaminen in Ranitidin und anderen Arzneimitteln veröffentlicht.
HPLC in Verbindung mit hochauflösender Massenspektrometrie (HPLC-HRMS oder LC-HRMS) ist ein weiteres wichtiges Verfahren für die Nitrosaminanalyse. Die Selektivität dieser Methode macht es möglich, Nitrosamin-ähnliche Verunreinigungen von tatsächlichen Nitrosaminen zu unterscheiden und so die Zuverlässigkeit der Testergebnisse zu gewährleisten. Die FDA hat LC-HRMS-Methoden entwickelt und validiert,17 und in Verfahren 1 von USP <1469> wird diese Methode ebenfalls beschrieben.7
HPLC mit UV/VIS-Detektion kommt ebenfalls für die Nitrosaminanalyse zum Einsatz. Auch wenn die UV/VIS-Spektroskopie im Vergleich zur LC-MS/MS eine geringere Empfindlichkeit aufweist, kann sie zur schnellen Analyse von Rohstoffen, Lösungsmitteln oder Hilfsstoffen verwendet werden. Die französische ANSM (Agence Nationale de Sécurité du Médicament et des Produits de Santé) empfiehlt zwei Methoden, die auf HPLC-UV-Detektion basieren.18,19
Die Gaschromatographie mit Massenspektrometrie-Kopplung (GC-MS/MS) ist eine weitere häufig verwendete Methode zur Nitrosaminanalyse. Sie bietet eine ausgezeichnete Empfindlichkeit und Spezifität für den Nitrosaminnachweis und eignet sich besonders für den Nachweis flüchtiger Nitrosamine. USP <1469>,10 Taiwan FDA,13 und Swissmedic20 nutzen GC-MS/MS-Methoden für Nitrosaminprüfungen, und die Health Sciences Agency (HSA) von Singapur hat eine Methode veröffentlicht, die auf Gaschromatographie-Massenspektrometrie mit hochauflösender exakter Massenbestimmung (HRAM-GCMS) basiert.21
Anforderungen an die Probenfilterung für die Nitrosaminanalyse
Die meisten der oben genannten Methoden erfordern eine Filtration der Probe vor der Injektion. Filtration ist die einfachste Methode, vor der Injektion Partikel aus Proben und mobilen Phasen zu entfernen, die die Leistung des HPLC-Geräts erheblich beeinträchtigen könnte. In Arzneimitteln wie Valsartan sind Partikel sehr häufig. Sie entstehen beim Auflösen der Formulierung. Die Porengröße eines Membranfilters bestimmt, in welchem Umfang er Partikel in einer Probe zurückhalten kann. Bei HPLC-Methoden beträgt die Porengröße in der Regel 0,45 µm. Bei der Verwendung von Säulen mit kleinpartikulärem Packungsmaterial (z. B. Partikel unter 2 µm) und bei UHPLC-Verfahren wird ein 0,2-μm-Filter empfohlen. Es ist wichtig zu beachten, dass Membranfilter der gleichen Porengröße nicht immer die gleiche Retentionseffizienz aufweisen, wie in einer früheren Studie gezeigt.22
In Tabelle 2 sind die Filtrationsschritte bei bestimmten Methoden aufgeführt, die von Regulierungsbehörden weltweit veröffentlicht wurden. Bei Verfahren zur Nitrosaminanalyse werden Spritzenvorsatzfilter bevorzugt. Zwei wichtige Eigenschaften von Spritzenvorsatzfiltern sind das Membranfiltermaterial und die Porengröße. PVDF und PTFE sind die häufigsten Membranfiltermaterialien, die in den veröffentlichten Analysemethoden genannt werden. Nylon und hydrophiles Polypropylen (z. B. GHP-Membran) werden in einigen Fällen ebenfalls erwähnt (Tabelle 2). Die Porengrößen in den Methoden sind 0,2 μm, 0,22 μm und 0,45 μm.
Experimentelle Methoden
In dieser Studie wurde die zuvor validierte Methode gemäß Verfahren 3 von USP <1469> verwendet.31 Teil 1 ist eine Studie zu Nitrosaminverunreinigungen, die von Spritzenvorsatzfiltereinheiten zurückgehalten werden können, und Teil 2 ist eine Wiederfindungsstudie mit dotiertem Valsartan. Die LC-MS/MS-Bedingungen sind in Tabelle 3 und MRM-Übergänge in Tabelle 4 dargestellt.
Getestete Spritzenvorsatzfilter. Getestet wurden jeweils drei Einheiten aus zwei verschiedenen Chargen von (1) Millex® – PVDF (0,22 µm) und (2) Millex® – PTFE (0,2 µm) sowie jeweils drei Einheiten aus einer Charge von (3) Lieferant P – PVDF (0,2 µm), (4) Lieferant C – H-PTFE (0,2 µm), (5) Lieferant M – PVDF (0,2 µm) und (6) Lieferant M –PTFE (0,2 µm).
Teil 1 – Extrahierbare Substanzen. Um festzustellen, ob es Ausgangswerte für die mit Spritzenvorsatzfiltern extrahierbaren Nitrosaminverunreinigungen gab, wurde eine Probe mit ausschließlich Verdünnungsmittel (0,1 % Volumenanteil Ameisensäure in Wasser) mit vier isotopisch markierten internen Standards (IS) gemäß USP <1469> versetzt (10 µg/ml für NDMA-d6 und NMBA-d3 und 1 µg/ml für NDEA-d10/NDBA-d18). Die Proben wurden verwirbelt und zentrifugiert (10.000 U/min für 10 Minuten), und der Überstand wurde mit 13-mm-Spritzenvorsatzfiltern gefiltert. Das Filtrat wurde mittels LC-MS/MS auf sechs Nitrosaminverbindungen analysiert. Die Konzentrationen wurden anhand einer externen Kalibrierkurve von 1,33–90 ng/ml (NDMA, NMBA, NEIPA, NDIPA und NDBA) und 0,66–69,4 ng/ml (NDEA) bestimmt.
Teil 2 – Wiederfindung. 40 mg Valsartan dura (80-mg-Dosis) wurden pulverisiert, mit 1%iger Ameisensäure in Wasser verdünnt und in niedriger (Level-2-)Konzentration gemäß USP <1469> dotiert. Die Probe wurde dann zentrifugiert, gefiltert und mittels LC-MS/MS analysiert.
Bewertung von Filtern für die Nitrosaminanalyse
Die Filtration von Proben vor der Probeninjektion ist Teil vieler LC-MS- und GC-MS-basierter Methoden zur Prüfung auf Nitrosaminverunreinigungen. Es ist von entscheidender Bedeutung, sicherzustellen, dass keine extrahierbaren Substanzen die Filtereinheiten passieren, um bei diesen Methoden die Genauigkeit und Konsistenz der Daten aufrechtzuerhalten. Darüber hinaus ist es wichtig, Untersuchungen zur Wiederfindung durchzuführen, da bestimmte Moleküle das Potenzial haben, sich an die Komponenten eines Spritzenvorsatzfilters zu haften, und somit die Qualität der generierten Daten beeinflussen können.
Zur Bewertung der Spritzenvorsatzfilter wurde eine validierte Methode basierend auf Verfahren 3 von USP <1469> verwendet.27 Diese USP-Methode beschreibt den Einsatz von LC-MS/MS zur Quantifizierung von NDMA, NDEA, NDIPA, NEIPA, NMBA und NDBA bei ausgewählten Sartanen (Valsartan, Losartan Kalium, Olmesartanmedoxomil, Candesartancilexetil und Telmisartan). Der letzte Teil des Unterabschnitts „Probenlösung“ des Verfahrens erfordert die Filtration „unter Verwendung eines hydrophilen Polytetrafluorethylen(PTFE)-Filters mit einer Porengröße von 0,45 μm“ nach dem Zentrifugieren.11
Teil 1 – Extrahierbare Substanzen
Das Filtrat der Spritzenvorsatzfilter wurde anhand einer externen Kalibrierkurve von 1,33–90 ng/ml (NDMA, NMBA, NEIPA, NDIPA und NDBA) und 0,66–69,4 ng/ml (NDEA) auf extrahierbare Nitrosaminsubstanzen analysiert. Abbildung 1 zeigt ein Beispiel für ein MRM-Chromatogramm dieser Verbindungen.
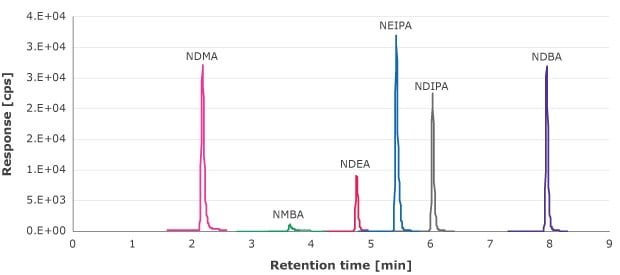
Abbildung 1.MRM-Chromatogramm der Nitrosamin-Standardlösungen (10 ng/ml für NDMA, NMBA, NEIPA, NDIPA und NDBA sowie 6,6 ng/ml für NDEA)
Die Bestimmungsgrenze (Limit of Quantitation, LOQ) ist definiert als die Konzentration, die ein SRV von 10 ergibt. Die niedrigste Konzentration der Kalibrierkurven für jede analysierte Nitrosaminverunreinigung hatte ein SRV von > 10. In keinem der getesteten Spritzenvorsatzfilter wurden Nitrosamine bei oder über diesem Wert nachgewiesen (Tabelle 5).
ABKÜRZUNGEN: SNV = Signal-Rausch-Verhältnis; PVDF = hydrophiles Poly(vinyliden)fluorid; PTFE = hydrophiles Polytetrafluorethylen; LOQ = Bestimmungsgrenze; n. n. = nicht nachgewiesen
Es ist entscheidend, sicherzustellen, dass Filtereinheiten keine chemisch extrahierbaren Substanzen enthalten, die sich negativ auf die Datenqualität auswirken könnten, insbesondere bei Methoden, bei denen hochsensible Geräte verwendet werden. Extrahierbare Substanzen sollten vermieden werden, da sie mit Analyten-Peaks koeluieren oder in nachgelagerten Analysen als unerwartete Peaks auftauchen können, was die Dateninterpretation erschwert. Bei den Quellen der extrahierbaren Substanzen kann es sich um Ablösungen von Filtermaterial, Chemikalienrückstände aus dem Herstellungsprozess oder chemische Sekundärprodukte, die aus dem Filter ausgewaschen werden, handeln. Bei spezifischen Analyten wie Nitrosaminverbindungen könnten extrahierbare Substanzen versehentlich während der Membranherstellung formuliert werden.
Teil 2 – Wiederfindung in Valsartan
Die Wiederfindungsstudie wurde durchgeführt, indem die Valsartan-Probe mit Referenzstandards bei niedriger Konzentration (L2) dotiert wurde. Die vorbereiteten Probenlösungen wurden mittels LC-MS/MS analysiert, wobei eine externe Kalibrierkurve zur Berechnung der einzelnen Analytenkonzentrationen verwendet wurde. Das Verhältnis zwischen dem Signal des internen Standards und dem Signal des Analyten (z. B. Signal für NDMA-D6 / Signal für NDMA) wurde in der Probenlösung und in den externen Kalibrierungslösungen bestimmt.
Tabelle 6 zeigt die durchschnittliche Wiederfindungsrate bei den getesteten PVDF- und PTFE-Spritzenvorsatzfiltern. Die Wiederfindungsraten lagen bei allen getesteten Produkten und Materialien innerhalb eines akzeptablen Bereichs von 70 bis 130 %31, wobei einige geringfügige Unterschiede zwischen Verbindungen und Filtermaterial zu erkennen sind. Beispielsweise zeigte NDBA vergleichsweise geringe Wiederfindungsraten (immer noch im akzeptablen Bereich), möglicherweise aufgrund seiner hydrophoben Wechselwirkungen mit Filtermedien oder Inhaltsstoffen des Arzneimittels. Die hydrophilen PVDF- und PTFE-Spritzenvorsatzfilter der Marke Millex® zeichneten sich beide über alle Chargen hinweg durch eine konsistente Wiederfindungsrate aus.
Die Bindung von Analytmolekülen an die Filtereinheit ist ein weiterer Faktor, der bei der Auswahl von Spritzenvorsatzfiltermaterialien zu berücksichtigen ist, da die Bindung zu schlechten Wiederfindungsraten führen kann. Die physikalisch-chemischen Eigenschaften der Filtereinheit (Membranfilter und Gehäuse) und die chemischen Eigenschaften des Analyten bestimmen das Ausmaß der Bindung. Verschiedene Sekundärwechselwirkungen, wie elektrostatische Wechselwirkungen, Wasserstoffbrückenbildung und hydrophobe Wechselwirkungen, tragen zur Bindung des Analyten an den Membranfilter und das Gehäuse bei.32 In dieser Studie könnte die relativ geringere Wiederfindungsrate für NDMA bei PVDF- und PTFE-Membranfiltern (noch im akzeptablen Bereich) auf hydrophobe Wechselwirkungen zwischen dem NDMA und der Membran zurückzuführen sein. NDIPA wies bei den PVDF-Membranen geringere Wiederfindungsraten auf, was darauf hindeutet, dass das Molekül möglicherweise anders mit PTFE als mit PVDF-Polymeren interagiert. Andere Polymere mit polaren funktionellen Gruppen und höherer Affinität für unspezifische Bindungen, wie Nylon, würden wahrscheinlich stärkere Bindungen eingehen und damit höhere Verluste an Analyten aufweisen. Für eine möglichst genaue Wiederfindung sollte daher der erste Milliliter Filtrat während der Probenvorbereitung entsorgt werden, wie in den Methoden der US-amerikanischen FDA für Nitrosamintests empfohlen.23,24 Auf diese Weise wird sichergestellt, dass die Bindungsstellen mit Analyt gesättigt sind und somit kein zusätzlicher Analytenverlust entsteht. Wir haben dieses Phänomen auch bei Membranmaterialien mit hohen Bindungseigenschaften wie Nylon beobachtet.
Prüfung auf Nitrosaminverunreinigungen und Filterauswahl
Alle getesteten PVDF- und PTFE-Spritzenvorsatzfilter zeigten Konzentrationen an extrahierbaren Nitrosaminsubstanzen unterhalb der Bestimmungsgrenze gemäß USP-<1469>-Verfahren 3. Darüber hinaus wiesen sie alle annehmbare Wiederfindungsraten für die zugesetzten Nitrosaminanalyten auf. Zwischen den Filtern bestanden nur geringfügige Unterschiede bei den verschiedenen Verbindungen. Dies bestätigt die Eignung dieser Filtermedien zur Probenvorbereitung für Nitrosamin-Analysemethoden.
Verwandte Anwendungen
- Analyse & Qualitätskontrolle (QC) niedermolekularer Wirkstoffe
Die Analyse niedermolekularer Wirkstoffe, sogenannter Small Molecules, und die Qualitätskontrolle (QC) in Übereinstimmung mit den Spezifikationen der internationalen Pharmakopöen sind für die Arzneimittelentwicklung von entscheidender Bedeutung. In der analytischen Chemie und mikrobiellen Testverfahren wird sichergestellt, dass Small Molecules gemäß der Guten Herstellungspraxis (GMP) entwickelt und hergestellt werden.
- Arzneibuchprüfungen & regulatorische Leitlinien
Arzneibuchprüfungen, auch als Arzneibuch- oder Pharmakopöe-Standards bezeichnet, werden zur Beschreibung der Qualitätsstandards verwendet. Zahlreiche globale Standards wie ICH, USP, Ph Eur, JP, FDA CFR, ISO und ACS bieten lokale und internationale Leitlinien für die pharmazeutische Analyse und Qualitätskontrolle (QC) und deren Einhaltung.
Literatur
Um weiterzulesen, melden Sie sich bitte an oder erstellen ein Konto.
Sie haben kein Konto?