Análisis de las PFAS extraíbles en productos de filtración utilizando la metodología EPA 537.1 modificada
Pulse en los enlaces siguientes para navegar a las secciones:
- Contaminantes en los análisis de PFAS
- Análisis de los filtros de jeringa de nailon y de PES Millex® con muestras de agua utilizando la metodología EPA 537.1 modificada
- Análisis de las membranas de filtración de polipropileno Millipore® con muestras de agua utilizando la metodología EPA 537.1 modificada
- Productos de filtración recomendados
Contaminantes en los análisis de PFAS
Una consideración clave para cualquier método PFAS es evitar la contaminación que puede afectar a la precisión de los datos, como los procedentes de técnicas de preparación de muestras como la filtración. Actualmente, la mayoría de los métodos analíticos de PFAS están pensados para matrices “limpias”, como el agua potable, y a menudo no requieren filtración como parte de la preparación de la muestra. Sin embargo, métodos como los SW-846 8327, ASTM D7968, ASTM D7979, EPA 1633 e ISO 21675 implican matrices que podrían tener un mayor grado de partículas, como las aguas residuales. Las partículas en disolución deben eliminarse antes de la LC-MS/MS, ya que pueden ser perjudiciales para el análisis de la muestra, la longevidad de la columna y la función general del equipo. Estos métodos identifican la necesidad de filtración utilizando membranas en formato de filtro de jeringa.
Se utilizó un método EPA 537.1 modificado para demostrar que los filtros de jeringa Millex® de polietersulfona (PES) y nailon y las membranas de polipropileno Millipore® no presentan niveles detectables de PFAS contaminantes procedentes de extraíbles fluorados.
Análisis de los filtros de jeringa de nailon y de PES Millex® con muestras de agua utilizando la metodología EPA 537.1 modificada
Materiales y método
Se analizaron los extraíbles PFAS en tres lotes de filtros de jeringa Millex® de polietersulfona (PES), tres lotes de nailon y dos lotes de nailon-HPF (membrana de nailon con un prefiltro de fibra de vidrio para la filtración de elevado contenido de partículas) según el método 537.1 de la EPA. También se incluyeron algunos compuestos PFAS no requeridos por el método, como los compuestos de PFAS de próxima generación y los sulfonatos de fluorotelómero. La metodología EPA 537.1 no requiere filtración de las muestras, pero se utilizó filtración para proporcionar una muestra limpia que permitiera analizar los niveles de contaminación por extraíbles del filtro de jeringa.
En la secuencia de trabajo siguiente se describe una visión general del método, con las condiciones de LC-MS/MS indicadas en la Tabla 1. En resumen, una muestra de 250 ml de agua DI sin PFAS se enriqueció con sustitutos. Para los blancos de control de calidad se utilizaron 0,08 ppb de patrón interno como enriquecimiento. Para determinar si los medios de filtración de la muestra contribuyen a la contaminación con PFAS, se hizo pasar toda la muestra por el filtro y en un cartucho de SPE de estireno-divinilbenceno (SDVB). Las botellas y tubos de muestra se enjuagaron con metanol básico, luego se hicieron pasar por el filtro y al interior del cartucho. La muestra entera se sometió a SPE y se concentró hasta 1 ml en metanol:agua al 96:4 % (v/v) antes del análisis mediante LC-MS/MS utilizando una columna C18. El análisis se realizó utilizando patrones internos. En este estudio se utilizaron patrones marcados con C-13. Los filtros analizados fueron: tres lotes de filtros de jeringa Millex®-GP (filtro no estéril,de 33 mm con membrana de PES Millipore Express® PLUS) en ambos, un tamaño de poro de 0,22 µm (Nº ref. SLGP033N) y 0,45 µm (Nº ref. SLHP033N), tres lotes de filtros de jeringa de nailon Millex® (filtro no estéril, de 33 mm con membrana de nailon) con 0,20 µm de tamaño de poro (Nº ref. SLGN033N) y dos lotes de filtros de jeringa Millex® de nailon-HPF (filtro no estéril, de 25 mm con membrana de nailon y prefiltro de fibra de vidrio) con tamaño de poro de 0,20 µm (Nº ref. SLGNM25).
Secuencia de trabajo del método utilizado para la metodología EPA 537.1 modificada:
Secuencia de trabajo


Filtro
Se filtran las muestras utilizando un filtro de jeringa Millex®.
Extracción en fase sólida
Se extraen los analitos de la muestra mediante extracción en fase sólida (SPE).
Concentración
Los extractos se concentran por evaporación con nitrógeno utilizando un baño María
LC/MS/MS
Los extractos concentrados se analizan mediante LC-MS/MS.
Resultados
No hubo PFAS contaminantes detectables en ninguno de los dispositivos Millex® probados utilizando el método EPA 537.1 modificado por encima de los límites de notificación (RL) o los límites de detección mínimos (MDL), incluso teniendo en cuenta los umbrales muy bajos de 0,0020-0,0080 ppb y 0,0010-0,0020 ppb, respectivamente, dependiendo del compuesto (Tabla 2). Los resultados fueron los mismos para los tres lotes diferentes de las membranas de PES de 0,22 y 0,45 µm, los tres lotes diferentes de membranas de nailon de 0,20 µm y los dos lotes diferentes de membranas de nailon-HPF de 0,20 µm. Estos resultados sugieren que los dispositivos de filtración Millex® de PES, nailon y nailon-HPF son fiables y apropiados para utilizar en la filtración de muestras de agua en preparación para el análisis de estos compuestos PFAS.
Recuperación
En este estudio, los tubos de muestra y las botellas de muestra se enjuagaron con metanol básico. Las recuperaciones de los patrones marcados con C-13 estuvieron dentro del intervalo de control de calidad aceptable para el método. Sin embargo, la recuperación varió de un material filtrante a otro (Figura 1) y de un compuesto a otro. Por ejemplo, los filtros de nailon demostraron menores recuperaciones que los filtros de PES. En el caso de las membranas de nailon, la adsorción inespecífica de los patrones internos enriquecidos y la muestra puede reducirse usando un enjuague de metanol. Resultados similares se encontraron utilizando membranas de PES solas (sin carcasa y filtrado utilizando un portafiltros Swinnex® de 25 mm).
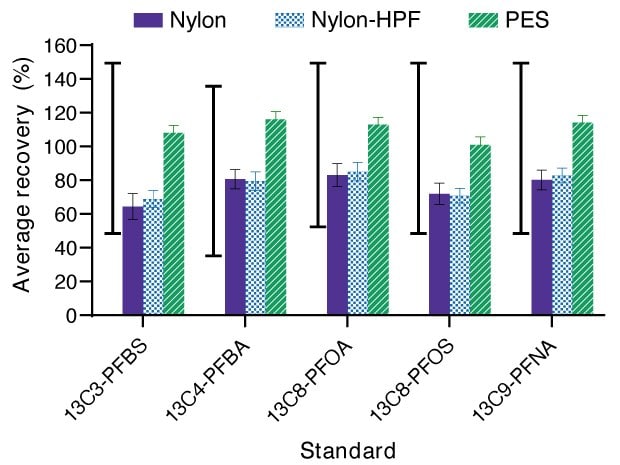
Figura 1.Porcentaje promedio de recuperación de los patrones marcados con C-13 para PFBS, PFBA, PFOA, PFOS y PFNA después de la filtración con filtros de jeringa Millex® de nailon (morado, media ± desviación estándar (STDEV), n=9 replicas en 3 lotes), nailon-HPF (azul con patrón comprobado, media±STDEV, n=6 replicas en 2 lotes) y PES (verde con marcas de barra diagonal, media±STDEV, n=9 replicas en 3 lotes). La línea vertical continua negra a la izquierda de cada compuesto indica el intervalo de control de calidad aceptable para la recuperación de los patrones internos.
Análisis de las membranas de filtración de polipropileno Millipore® con muestras de agua utilizando la metodología EPA 537.1 modificada
Los filtros de jeringa son el formato más recomendado y preferido para filtrar muestras destinadas al análisis mediante LC-MS/MS de PFAS debido a la facilidad de uso y la gama de volúmenes pequeños que se pueden procesar (10-100 ml). Sin embargo, hay casos en los que los filtros de jeringa pueden no ser la mejor opción para la filtración; por ejemplo, cuando no existen filtros de jeringa comercializados adecuados para una aplicación específica. En estos casos, debe considerarse una alternativa. Un dispositivo similar a un filtro de jeringa, como un soporte Swinnex®, es una alternativa viable. Este dispositivo accionado por presión sostiene cualquier disco de membrana de filtración cortada en un tamaño específico (13 mm o 25 mm de diámetro) y funciona de la misma manera que un filtro de jeringa tradicional, convirtiendo así cualquier material de membrana en un formato de filtro de jeringa.
ASTM D7979 (para la detección de PFAS en matrices de agua, excluida el agua potable) y ASTM D7968 (para la detección de PFAS en sólidos ambientales) sugieren el uso de polipropileno para la preparación y la filtración de muestras. El polipropileno es un material duradero compatible con una amplia gama de disolventes y temperaturas, y demuestra bajos extraíbles, por lo que se convierte en específicamente apropiado para la preparación de muestras relacionadas con PFAS y fase móvil. Un problema con el polipropileno es que es hidrófobo de manera natural, lo que hace que sea difícil filtrar muestras acuosas. La mayor parte de los discos de filtración de polipropileno disponibles en el mercado son hidrófobos, como las membranas de filtración de polipropileno Millipore® (Nº de referencia PPTG04700 y Nº de referencia PPTH04700). Aunque es apropiado para disolventes como el metanol, puede resultar complejo filtrar muestras acuosas. En algunos casos, el polipropileno puede encontrarse en un formato hidrófilo (membranas de filtración de polipropileno hidrófilo Millipore®, Nº de referencia PPHG04700 y Nº de referencia PPHH04700). Estos filtros son adecuados para manejar muestras acuosas. Por consiguiente, al darnos cuenta del potencial de uso del material de polipropileno en el contexto de una variedad de secuencias de trabajo de las PFAS, como la filtración de la fase móvil, determinamos el nivel de PFAS extraíbles que liberan estos discos filtrantes.
Materiales y método
Montaje de portafiltros Swinnex®
Se analizó el contenido de PFAS extraíble de las membranas de filtración de polipropileno (PP) Millipore® hidrófilas e hidrófobas de 0,2 µm y 0.45 µm de tamaño de poro. Los dispositivos Swinnex® (25 mm de diámetro) se utilizaron para convertir los diversos discos de membrana de filtración en un filtro de jeringa utilizando un cierre Luer, de acuerdo con la Figura 2. Una vez montado, el dispositivo Swinnex® puede conectarse mediante un cierre Luer al tambor de la jeringa-con el material que vaya a filtrarse. A continuación se realizó la filtración como con otros filtros de jeringa. Para cada réplica de disco, se utilizó un dispositivo Swinnex® nuevo y limpio.

Figura 2A.Colocación de juntas tóricas

Figura 2B.Manejo de filtros

Figura 2C.Colocación del filtro

Figura 2D.Fijación de la junta

Figura 2E.Montaje del portafiltros Swinnex®
EPA 537.1 modificada
En esta parte del estudio, se probaron cuatro tipos de discos de 25 mm de membrana de filtración cortada:
- PP hidrófobo de 0,2 µm (Nº de ref. PPTG02500)
- PP hidrófobo de 0,45 µm (Nº de ref. PPTH02500)
- PP hidrófilo de 0,2 µm (Nº de ref. PPHG02500)
- PP hidrófilo de 0,45 µm (Nº de ref. PPHH02500)
Una vez que cada disco de membrana de filtración cortado se colocó de forma segura en un dispositivo Swinnex®, se hicieron pasar por cada filtro y en un cartucho SPE de estireno-divinilbenceno (SDVB) 250 ml de muestras de agua enriquecida con sustitutos utilizando la metodología EPA 537.1 para matrices de agua potable como guía. La muestra entera se sometió a SPE y se concentró de acuerdo con los procedimientos descritos en la secuencia de trabajo anterior. La LC-MS/MS con columna C18 se realizó de acuerdo con las condiciones de la Tabla 1 y el análisis se llevó a cabo utilizando patrones internos para determinar si había niveles de extraíbles presentes en los discos de membrana de filtración de PP. Se probó un lote (n=3 filtros por lote) por tipo de membrana.
Es importante señalar la dificultada para que fluya el agua purificada a través de membranas de filtración de PP hidrófobas; por lo tanto, para mejorar el flujo de agua de estas muestras, los discos de membrana de filtración cortados se humedecieron previamente en metanol antes de filtrar 250 ml de agua. No hubo necesidad de prehumedecer los discos de membrana de filtración de PP hidrófilos .
Resultados
Como se observó para los filtros de jeringa Millex®, no hubo PFAS contaminantes detectables en ninguno de los discos de membrana de filtración de polipropileno según el método EPA 537.1 modificado por encima del RL, que va de 0,0020 a 0,0080 ppb, o el MDL, que va de 0,0010 a 0,0020 ppb (Tabla 3). Esto indica que estas membranas no tienen PFAS extraíbles en estos límites y podrían utilizarse para aplicaciones PFAS donde se necesita filtración para la preparación de las muestras.
Sin embargo, solo para las membranas de polipropileno hidrófobo, hubo cuatro compuestos (ácido perfluoro-n-dodecanoico (PFDoDA), ácido perfluoro-n-tridecanoico (PFTrDA), ácido perfluoro-n-tetradecanoico (PFTeDA) y ácido N-etil perfluorooctano-sulfonamidoacético (N-EtFOSAA)) donde no había compuestos PFAS detectables, pero los patrones asociados de 13C2-PFDoA, 13C2-PFTeDA y D5-NEtFOSAA demostraron recuperaciones fuera de los límites de control del 40-140 %, 30-130 % y 40-140 %, respectivamente. Estos compuestos demostraron recuperaciones promedio de aproximadamente ~el 15-25 % (para PFDoDA, PFTrDA y PFTeDA) y el 30-33 % (para N-EtFOSAA). Esto indica que la adsorción inespecífica de estos compuestos en el polipropileno hidrófobo podría ser significativa en el agua. Teniendo en cuenta las largas longitudes de cadena y los grupos funcionales voluminosos de estos compuestos, existe la posibilidad de interacciones hidrófobas y estéricas con los medios de filtración y otros fungibles. Curiosamente, las recuperaciones de polipropileno hidrófilo se mantuvieron dentro de los límites de control para todos los compuestos, lo que indica que la hidrofilización del material de membrana redujo cualquier interacción inespecífica con los patrones de PFAS.
Recuperación
Membranas de polipropileno hidrófobas frente a hidrófilas
En muestras de agua, las membranas de polipropileno hidrófilas probadas demostraron recuperación de patrones internos dentro del intervalo de control de calidad, mientras que las membranas hidrófobas no lo hicieron (Figura 3). Las recuperaciones para 13C2-PFDoDA, 13C2-PFTeDA y D5-EtFOSAA demostraron de manera continua una recuperación fuera del intervalo de control de calidad para el polipropileno hidrófobo, lo que dificultó la cuantificación del contenido verdadero de PFAS para estos compuestos. Dado que PFDoDA, PFTeDA y PFTrDA son moléculas de PFCA de cadena larga, la pérdida observada puede deberse a un impedimento estérico y a interacciones hidrófobas con el material de la membrana o material de la carcasa Swinnex®.
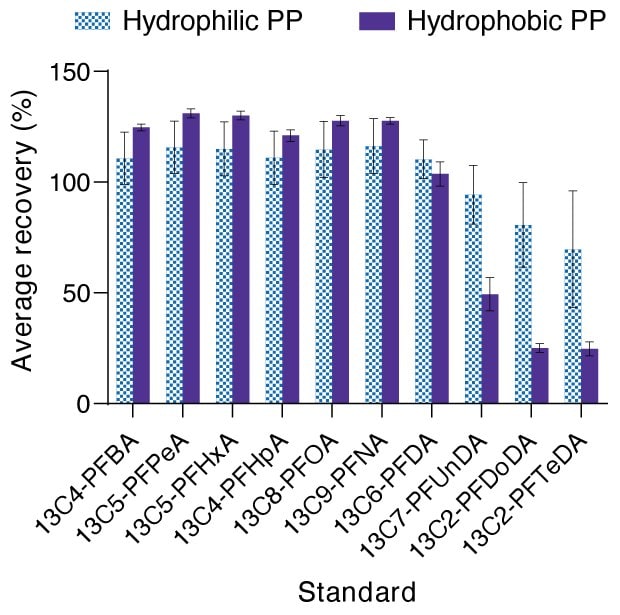
Figura 3.Porcentaje promedio de recuperación de los patrones marcados con C-13 para discos de membranas de filtración de polipropileno hidrófilos frente a hidrófobos en agua, sólo para la clase de ácido perfluoroalquilcarboxílico de PFAS. Los valores son media ± desviación estándar, n=3 réplicas. El intervalo de control de calidad para los patrones varía según el compuesto, de izquierda a derecha: 35-135 % (13C4-PFBA), 50-150 % (13C5-PFPeA hasta 13 C 6 -PFDA ), 40-140 % (13C2-PFDoDA), 30-130 % ( 13 C 2 -PFTeDA).
Para seguir leyendo, inicie sesión o cree una cuenta.
¿No tiene una cuenta?