ABN454
Anticorpo anti-tau oligomerica (T22)
serum, from rabbit
Sinonimo/i:
Microtubule-associated protein tau oligomer, Tau oligomer, PHF-tau oligomer, Paired helical filament-tau oligomer, Neurofibrillary tangle protein oligomer
Scegli un formato
CHF 633.00
Spedizione prevista il21 marzo 2025
Scegli un formato
About This Item
CHF 633.00
Spedizione prevista il21 marzo 2025
Prodotti consigliati
Origine biologica
rabbit
Livello qualitativo
Forma dell’anticorpo
serum
Tipo di anticorpo
primary antibodies
Clone
polyclonal
Reattività contro le specie
human
tecniche
ELISA: suitable
dot blot: suitable
immunofluorescence: suitable
immunohistochemistry: suitable
immunoprecipitation (IP): suitable
neutralization: suitable
western blot: suitable
N° accesso NCBI
N° accesso UniProt
Condizioni di spedizione
wet ice
modifica post-traduzionali bersaglio
unmodified
Informazioni sul gene
human ... MAPT(4137)
Descrizione generale
Specificità
Immunogeno
Applicazioni
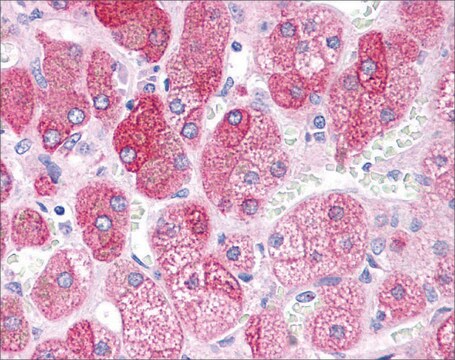
Immunostochimica: una diluizione di 1:245-1.000 di un lotto rappresentativo ha rilevato oligomeri di tau nella corteccia frontale di pazienti affetti da malattia di Alzheimer (AD) e da malattia dei corpi di Lewy (LBD) (per gentile concessione del Prof. Rakez Kayed, University of Texas, Galveston).
Immunofluorescenza: un lotto rappresentativo ha rilevato oligomeri di proteina tau in sezioni di tessuto cerebrale proveniente da persone affette da encefalopatia traumatica cronica (CTE), mentre nel caso di tessuti non-CTE l′immunoreattività si è rivelata assente o scarsa. L'immunoreattività degli oligomeri di tau ha colocalizzato con quella di tau pThr231 in conformazione cis, ma non con tau pThr231 in conformazione trans nel motivo pThr231-Pro232 (Kondo, A., et al.). (2015). Nature. 523(7561):431-436).
Immunofluorescenza: un lotto rappresentativo ha rilevato immunoreattività per la proteina tau oligomerica in sezioni di corteccia frontale incluse in paraffina provenienti da cervelli di individui affetti da malattia di Alzheimer (AD). (2012). FASEB J. 26(5):1946-1959).
Western blot: una diluizione di 1:1000 di un lotto rappresentativo ha rilevato la tau oligomerica nella encefalopatia traumatica cronica (CTE) in lisati di aggregati di tau
Western blot: lotti rappresentativi di questo anticorpo hanno rilevato la proteina tau oligomerica ma non la tau monomerica o altri tipi di proteine oligomeriche e fibrillari (Wu J.W., et al. (2013). J. Biol. Chem. 288(3):1856-1870; Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946-1959).
Dot Blot: un lotto rappresentativo ha rilevato gli oligomeri di proteina tau mentre non ha rilevato la tau in forma monomerica o in forma di filamenti elicoidali accoppiati (PHFs) (Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946-1959).
ELISA: lotti rappresentativi di questo anticorpo hanno rilevato oligomeri di tau formati in vitro, così come oligomeri di tau in estratti cerebrali solubili in PBS ottenuti da pazienti con paralisi sopranucleare progressiva (PSP) (Lasagna-Reeves, C.A., et al. (2012). Sci. Rep. 2:700; Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946-1959).
Analisi ELISA: un lotto rappresentativo ha mostrato reattività specifica per la proteina tau oligomerica, esibendo per contro una immunoreattività molto ridotta nei confronti della tau fibrillare e nessuna reattività per la tau monomerica o per altri tipi di oligomeri o di fibrille proteiche (ad es. A,β α-sinucleina, o polipeptide amiloide insulare) (Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946-1959).
Immunoprecipitazione: lotti rappresentativi di questo anticorpo hanno immunoprecipitato la proteina tau oligomerica da cervelli affetti da malattia di Alzheimer (AD), ma non da cervelli non-AD (Lasagna-Reeves, C.A., et al. (2012). Sci. Rep. 2:700; Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946-1959).
test di neutralizzazione: lotti rappresentativi di questo anticorpo hanno neutralizzato la tossicità della proteina tau oligomerica in cellule di neuroblastoma umano SH-SY5Y (Lasagna-Reeves, C.A.,et al. (2012). Sci. Rep. 2:700; Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946-1959).
Immunoistochimica: un lotto rappresentativo ha rilevato l′immunoreattività per tau oligomerica in sezioni di cervello incluse in paraffina ottenute da pazienti affetti da paralisi sopranucleare progressiva (PSP) (Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946-1959).
Neuroscienze
Malattie neurodegenerative
Qualità
Western blot: una diluizione di 1:1.000 di questo anticorpo ha rilevato oligomeri di tau nei tessuti cerebrali di persone affette da malattia di Alzheimer (AD), ma non in quelle non affette.
Descrizione del bersaglio
Stato fisico
Stoccaggio e stabilità
Indicazioni per l'uso: una volta ricevuto il prodotto, prima di rimuovere il tappo, centrifugare il contenitore e mescolare delicatamente la soluzione. Suddividere in aliquote in provette da microcentrifuga e conservare a -20°C. Evitare ripetuti cicli di congelamento e scongelamento che potrebbero danneggiare le IgG e compromettere le prestazioni del prodotto.
Esclusione di responsabilità
Non trovi il prodotto giusto?
Prova il nostro Motore di ricerca dei prodotti.
Raccomandato
Codice della classe di stoccaggio
10 - Combustible liquids
Classe di pericolosità dell'acqua (WGK)
WGK 1
Certificati d'analisi (COA)
Cerca il Certificati d'analisi (COA) digitando il numero di lotto/batch corrispondente. I numeri di lotto o di batch sono stampati sull'etichetta dei prodotti dopo la parola ‘Lotto’ o ‘Batch’.
Possiedi già questo prodotto?
I documenti relativi ai prodotti acquistati recentemente sono disponibili nell’Archivio dei documenti.
Active Filters
Il team dei nostri ricercatori vanta grande esperienza in tutte le aree della ricerca quali Life Science, scienza dei materiali, sintesi chimica, cromatografia, discipline analitiche, ecc..
Contatta l'Assistenza Tecnica.