Description générale
L'ubiquitine (Ub) est initialement produite sous la forme d'une protéine de 229 acides aminés précurseur de la polyubiquitine B (UniProt P0CG47) et codée par le gène UBB (identifiant du gène : 7314), ou sous la forme d'une protéine de 685 acides aminés précurseur de la polyubiquitine C (UniProt P0CG48) et codée par le gène UBC (identifiant du gène : 7316) chez l'être humain. Les clivages post-traductionnels produisent des copies multiples de molécules identiques d'ubiquitine de 76 acides aminés (également appelée protéine non-histone du groupe à haute mobilité HMG-20). L'ubiquitination est impliquée dans l'une des modifications post-traductionnelles (PTM) les plus courantes des protéines cellulaires, dans laquelle l'Ub est liée de manière covalente au niveau de son extrémité carboxyle (Gly76), généralement à des résidus de lysine dans les protéines cibles. Dans une cible donnée, un résidu de lysine peut être lié à une seule molécule Ub (mono-ubiquitylé) ou à une chaîne de molécules Ub (poly-ubiquitylé). Dans une chaîne polyUb, les molécules d'Ub peuvent être liées par l'un des sept résidus Lys (K6, K11, K27, K29, K33, K48 et K63) ou par le résidu Met1 de l'extrémité N-terminale de l'Ub (ce qui génère des chaînes linéaires). Lys-C est une endopeptidase qui clive les protéines du côté C-terminal des résidus de lysine non modifiés, mais pas des résidus de lysine modifiés par l'Ub. Ceci génère des fragments de peptide avec une lysine C-terminale et un(des) résidu(s) interne(s) de lysine liés à un reste d'Ub C-terminale (en raison du clivage par Lys-C entre Ub K63 et E64). Les anticorps qui ciblent de manière spécifique ce reste d'Ub C-terminale (c.-à-d. E64 à Gly76 ou E48 à Gly76 si le résidu K63 est ubiquitiné par une chaîne polyUb) sont compatibles avec la méthodologie brevetée UbiSite® pour la détermination du site d'ubiquitination de la lysine, développée par le laboratoire du Dr. Blagoy Blagoev à l'Université du Sud du Danemark. De tels anticorps peuvent isoler des fragments d'abord digérés par la Lys-C et comportant des sites de modification par l'Ub, puis soumis à une digestion supplémentaire par la trypsine pour laisser seulement le fragment Gly75-Gly76 lié de manière covalente à la lysine modifiée sur les fragments de peptides isolés avant de procéder à l'analyse par spectroscopie de masse (MS) afin de déterminer le(s) site(s) de modification de la lysine. Ils ont également exploité la technologie UbiSite® pour identifier les résidus de sérine et de thréonine soumis à l'ubiquitination catalysée par HOIL-1. Les résidus de thréonine en positions 12, 14, 22 et de sérine en position 20 de l'ubiquitine formeraient des liaisons ester avec le groupe carboxyle situé à l'extrémité C-terminale d'une autre molécule d'ubiquitine, augmentant ainsi le nombre de types de de liaisons possibles entre les molécules d'ubiquitine. La sérine en position 175 d'IRAK4 ainsi que la sérine en positions 136, 168 et la thréonine en position 168 d'IRAK2 ont été identifiées comme des sites d'ubiquitination catalysés par HOIL-1. (réf. : McCrory, EH., et al. (2022). Biochem. J. 479(23); 2419-2431; Akimov, V., et al. (2018). Nat. Struct. Mol. Biol. 25(7):631-640).
Spécificité
Des réactions croisées sont à prévoir avec un large éventail d'espèces, en raison des homologies de séquence conservées à 100 %.
Le clone 2G7B8 détecte les protéines mono-ubiquitinées (monoUb) et poly-ubiquitinées (polyUb), ainsi que la molécule libre d'ubiquitine (Ub), en ciblant la séquence C-terminale de l'Ub au niveau de la Lys63 (tag UbiSite). Le clone 2G7B8 peut être utilisé pour détecter (p. ex., par Dot blot) et isoler (p. ex., par immunoprécipitation) des peptides dérivés de protéines modifiées par l'Ub après digestion par l'endoprotéase Lys-C. La Lys-C clive l'Ub et les protéines modifiées par l'Ub après des résidus de lysine non modifiés, mais pas après des résidus de lysine modifiés par l'Ub. Ceci génère des fragments de peptides dont les résidus de lysine modifiés sont liés à un reste de séquence C-terminale de l'Ub (tag UbiSite) et qui ne peuvent pas être reconnus par d'autres anticorps anti-ubiquitine dont les épitopes se situent en N-terminal par rapport à la Lys63. Les fragments de peptides isolés peuvent ensuite être soumis à une analyse par spectroscopie de masse (MS) pour permettre l'identification des sites de modification par l'ubiquitine.
Immunogène
Peptide linéaireconjugué à de la KLH correspondant à 13 acides aminés de la région C-terminale del'ubiquitine humaine.
Épitope : zone proche de l'extrémité C-terminale.
Application
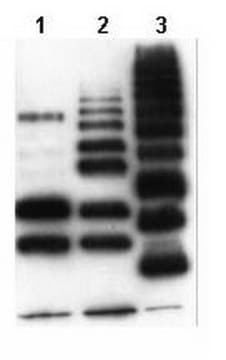
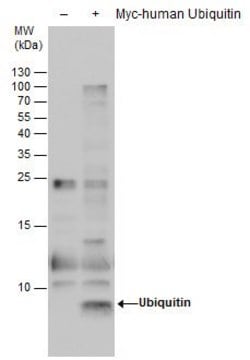
Analyse par western blotting : Une concentration de 1,0 µg/mL d'un lot représentatif a permis de détecter l'accumulation de protéines ubiquitinées dans des cellules épithéliales humaines HEp-2 à la suite d'un traitement par l'inhibiteur du protéasome MG-132 (Réf. 474790). (Avec l'aimable autorisation du Dr. Blagoy Blagoev à l'Université du Sud du Danemark.)
Domaine de recherche
Signalisation
L'anticorps anti-ubiquitine(pan) (également appelé anti-ubiquitine, UbiSite, clone 2G7B8) est un anticorps monoclonal de sourisqui permet de détecter l'ubiquitine et est utilisé en western blotting et en spectrométriede masse.
Sous-domaine de recherche
Ubiquitine et métabolisme de l'ubiquitine
Qualité
Produit évalué par western blotting sur un lysat de cellules épithéliales humaines HEp-2.
Analyse par western blotting : 2,0 µg/mL de cet anticorps a permis de détecter les protéines ubiquitinées dans 10 µg de lysat de cellules épithéliales humaines HEp-2.
Description de la cible
Variable en fonction de la taille des protéines ou des peptides ubiquitinés et du degré d'ubiquitination.
Forme physique
Anticorps IgG1κ monoclonal de souris purifié, dans un tampon contenant 0,1 M de Tris-glycine, pH 7,4, 150 mM de NaCl et 0,05 % d'azide de sodium.
Format : purifié
Purifié sur protéine G
Stockage et stabilité
Stable entre 2 et 8 °C pendant 1 an à compter de la date de réception.
Autres remarques
Concentration : voir la fiche technique du lot concerné.
Clause de non-responsabilité
Sauf indication contraire dans notre catalogue ou toute autre documentation associée au(x) produit(s), nos produits sont uniquement destinés à la recherche et ne sauraient être utilisés à d'autres fins, ce qui inclut, sans s'y limiter, les utilisations commerciales non autorisées, les utilisations diagnostiques in vitro, les utilisations thérapeutiques ex vivo ou in vivo, ou tout type de consommation ou d'application chez l'être humain ou chez l'animal.