La importancia de la filtración en la optimización del rendimiento de la (U)HPLC y la LC-MS
- Filtración en UHPLC, HPLC y LC-MS
- Retención de partículas en diferentes filtros de jeringa
- Evaluación de la vida útil de las columnas de HPLC con y sin filtración de las muestras
- Evaluación de membranas de filtración para la filtración de fases móviles
- Filtración, obstrucción de las columnas y análisis mediante HPLC
- Productos destacados
- Referencias bibliográficas
Filtros de jeringa Millex® para la filtración de muestras previstas para HPLC
Membranas de filtración y portafiltros Millipore® para filtración de fases móviles o disolventes
Es bien sabido que una técnica adecuada de preparación de muestras es fundamental para obtener datos de gran calidad. A veces se omite la filtración como una etapa de preparación de las muestras antes de los análisis mediante (U)HPLC y LC-MS, pero esto puede tener consecuencias no deseadas, ya que la presencia de partículas en las muestras y las fases móviles puede comprometer el rendimiento de la columna y del equipo. Investigamos la capacidad de los filtros de jeringa Millex® para retener partículas y los comparamos con los resultados obtenidos con otros filtros de jeringa. A continuación se correlacionó la eficiencia de retención (o porcentaje de retención) de partículas con la vida útil de la columna: se inyectaron muestras filtradas y no filtradas en un sistema de UHPLC y se supervisó la contrapresión hasta 500 inyecciones o hasta superar un límite de presión establecido. También evaluamos el impacto de la filtración de la fase móvil en la contrapresión de la columna. Estos datos demuestran la importancia de la filtración para optimizar la vida útil de las columnas de HPLC.
Filtración en la UHPLC, la HPLC y la LC-MS
La cromatografía de líquidos de alto rendimiento y de ultra alto rendimiento (HPLC, UHPLC) y la combinación de cromatografía de líquidos-espectrometría de masas (LC-MS) son métodos analíticos comunes en el desarrollo de fármacos y el control de calidad farmacéutico, la investigación académica y gubernamental, el análisis de alimentos sólidos y líquidos, y los análisis clínicos y ambientales. Una de las técnicas de preparación de muestras más simple y menos costosa es la filtración, es decir, la eliminación de partículas de las muestras.1 Las partículas no disueltas de una muestra, incluso a bajas concentraciones, pueden obstruir la columna de HPLC, induciendo una elevada contrapresión del equipo y una reducción de la vida útil de la columna, así como datos de poca calidad.2,3 Así pues, la eliminación de estas partículas de las muestras mediante filtración podría evitar estos problemas y al mismo tiempo ayudaría a proporcionar mejores datos cromatográficos.4
La filtración también es importante en la preparación de fases móviles para (U)HPLC y LC-MS.5,6,7 Los disolventes de grado HPLC, UHPLC, LC-MS y MS comercializados vienen prefiltrados y no hay que filtrarlos más cuando se utilizan como fase móvil directamente de la botella. Sin embargo, hay muchos métodos que precisan disoluciones tampón o mezclas para las fases móviles, en las cuales deben añadirse sales como fosfatos y acetatos.8 En tales casos, se recomienda filtrar la disolución tampón antes de utilizarla9 y siempre recién preparada.8
Exploramos la eficiencia de retención de varios filtros de jeringa. También comparamos la vida útil de la columna con y sin filtración de la muestra.
Retención de partículas en diferentes filtros de jeringa
La retención es un indicador del porcentaje de partículas que se eliminarán con éxito de una muestra durante la filtración o se dejarán atravesar el filtro hacia el instrumento. La retención de partículas se evaluó utilizando filtros de jeringa de cuatro fabricantes. Los filtros de jeringa consistían en politetrafluoroetileno hidrófilo (PTFE) o celulosa regenerada (RC). Se midió la retención de microesferas de 0,5 μm de diámetro por filtros de jeringa de 0,45 μm y de microesferas de 0,24 μm de diámetro por filtros de jeringa de 0,2 μm después de la filtración de disoluciones de microesferas al 0,05 % (v/v) en agua. Se hizo pasar la disolución de microesferas por n=4 filtros de jeringa por lote, y en la mayoría de los casos, se probaron varios lotes. Se recogió el filtrado después de filtrar 3 ml de disolución de microesferas, y luego se caracterizó mediante fluorescencia o espectrofotometría en comparación con una curva de calibración de seis puntos.
En la Tabla 1 se muestra la eficiencia de retención de los cuatro filtros de jeringa de 0,45 μm que se probaron La eficiencia de retención varió del material de membrana de filtración a otro. La celulosa regenerada demostró la menor retención (48,2+/-4,3%), mientras que los filtros de jeringa de PTFE demostraron una retención de aproximadamente el 98-100% de las microesferas de poliestireno.
En la HPLC, es suficiente la filtración a través de una membrana de filtración de 0,45 µm salvo que la columna esté rellena con partículas de pequeño tamaño (por ejemplo, partículas por debajo de 2 µm o UHPLC), en cuyo caso se necesita un filtro de 0,2 μm.5,10 Las columnas de UHPLC son más propensas a obstruirse debido a la menor porosidad de las fritas de entrada, los espacios intersticiales y el diámetro de los tubos. Por consiguiente, también se evaluó la retención de microesferas de 0,24 μm de diámetro por filtros de jeringa de 0,2 μm (Tabla 2). La eficiencia de retención de los filtros de celulosa regenerada (RC) es inferior al 20 %, lo que indica que más del 80 % de las partículas que debían filtrarse atravesaron la membrana. Los tres filtros de jeringa de PTFE hidrófilo demostraron eficiencias de retención variables. El MFR #2 obtuvo el valor más bajo en general a la vez que demostró también incoherencia de lote a lote.
Los datos de eficiencia de retención sugieren que no todos los filtros de jeringa del mismo tamaño de poro tendrán el mismo rendimiento en la filtración de la muestra.
Evaluación de la vida útil de una columna de HPLC con y sin filtración de muestras
La vida útil de la columna se evaluó con inyecciones repetidas de 10 μl de disoluciones de microesferas al 0,05 % (v/v) filtradas o no filtradas. La filtración se llevó a cabo en 30 viales certificados para HPLC utilizando n=30 dispositivos de los filtros de jeringa de 0,45 μm probados anteriormente. En la mayoría de los casos, se probaron varios lotes. Después de cada inyección, se supervisó el cambio en la contrapresión, hasta 500 inyecciones por columna o un corte de presión establecido de 8000 psi. Este corte se estableció para garantizar que el sistema no alcanzara un nivel de presión inseguro. En la
Tabla 3 se indican las condiciones de la HPLC.
Para cada prueba con cada filtro de jeringa de 0,45 μm se utilizó una nueva columna. Los tubos, el inyector, los precintos y el sistema de HPLC se limpiaron detenidamente entre cada prueba, tanto con la una columna instalada como sin ella, para garantizar que se habían eliminado todas las partículas de la prueba anterior. Cuando se instaló cada nueva columna, el sistema se enjuagó con 70:30 acetonitrilo:agua (1 ml/min) durante 10 minutos, y luego se equilibró con la fase móvil (Tabla 3) hasta establecer una contrapresión estable, aproximadamente 10-15 minutos.
Se utilizaron filtros de jeringa de 0,45 μm para filtrar disoluciones al 0,05 % (v/v) de microesferas de poliestireno de 0,5 μm de diámetro en viales certificados para HPLC. A continuación se inyectaron los filtrados en el instrumento de UHPLC. Se realizaron inyecciones repetidas de solo 10 μl hasta que alcanzar o superar el corte de contrapresión (8000 psi). Las muestras no filtradas también se inyectaron directamente. Los resultados se muestran en la Figura 1.
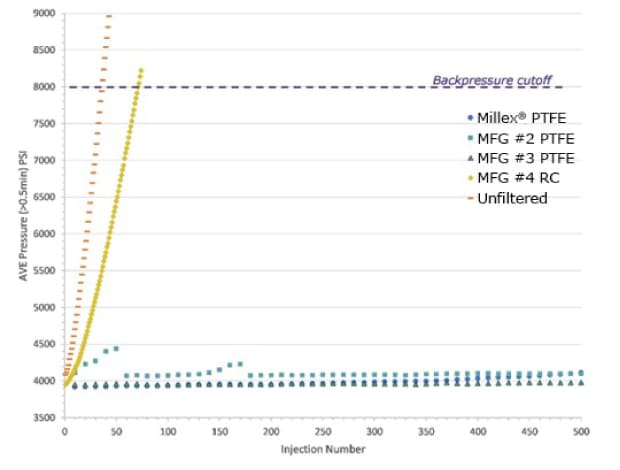
Figura 1. Efecto de la filtración de las muestras en la contrapresión del sistema de UHPLC. Se representa la contrapresión promedio (psi) frente al número de inyecciones de disoluciones de microesferas al 0,05% (v/v) filtradas y no filtradas de 0,5 μm de diámetro. Las muestras filtradas procedían de tres filtros de jeringa de PTFE hidrófilos de 0,45 μm y un filtro de jeringa de RC, cada uno de un fabricante diferente (MFR). También se inyectaron disoluciones no filtradas.
Solo se realizaron 36 inyecciones de la muestra sin filtrar antes de que la contrapresión superara el valor de corte de 8000 psi. El corte se superó después de 71 inyecciones de los filtrados obtenidos con el filtro de jeringa de RC. Esto indicaba que las partículas ocluían rápidamente la columna y que incluso una inyección de 10 μl reducía significativamente la vida útil de la columna. Este dato muestra correlación con los datos de eficiencia de retención en los que el filtro de jeringa de celulosa regenerada retuvo solo el 48 % de las partículas en una disolución, lo que significa que aproximadamente el 50 % de las partículas que debían haberse filtrado se inyectaron en cambio en el sistema UHPLC. De las muestras filtradas a través de PTFE todas pudieron inyectarse más de 500 veces sin mostrar cambios apreciables en la contrapresión de la columna. Esto se debió a que estos filtros de jeringa retuvieron casi el 100 % de las partículas, como se describió anteriormente.
Evaluación de membranas de filtración para filtración de fases móviles
La importancia de la filtración en las aplicaciones de (U)HPLC y LC-MS no se limita a la filtración de muestras. La presencia de partículas en la fase móvil también puede causar graves problemas en la (U)HPLC. En un estudio anterior de Joshi, et. al. se demostró que la eliminación incompleta de partículas de la fase móvil también produce un aumento de la contrapresión de columna de UHPLC (Figura 2).7,11 En ese estudio, la fase móvil compuesta por 50:50 acetonitrilo:agua se filtró a través de membranas de filtración de polipropileno (PP) y de PTFE hidrófilo (tamaños de poro de 0,2 μm y 0,45 μm). Se permitió que la fase móvil fluyera continuamente por una columna de UHPLC a un caudal de 0,25 ml/min, y se supervisó la contrapresión durante 600 minutos.
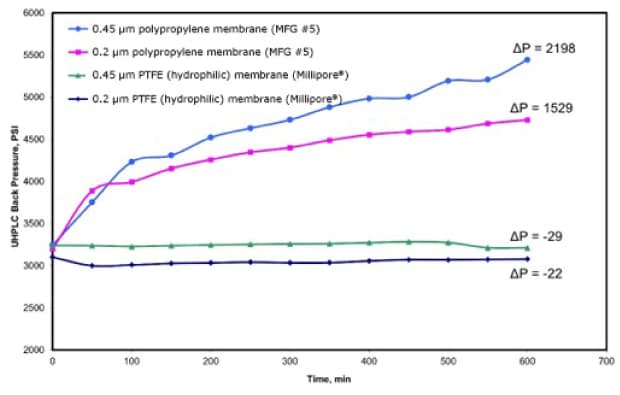
Figura 2. Cambio en la contrapresión (psi) del sistema de UHPLC frente al tiempo (min) con el flujo de la fase móvil a un caudal de 0,25 ml/min durante 600 minutos. La fase móvil se había filtrado a través de membranas de polipropileno (PP) y PTFE de 0,2 μm y 0,45 μm. (Reimpreso con permiso de de la referencia 11.)
De las cuatro membranas de filtración probadas, la fase móvil filtrada a través de la membrana de polipropileno de 0,45 μm y 0,2 μm indujo el mayor aumento de la contrapresión. Además de causar en la columna los mismos problemas que ya se han comentado, la presencia de partículas en la fase móvil puede provocar averías prematuras en los componentes del equipo, como las válvulas de retención de la bomba, los pistones y los precintos.12 Es importante señalar que, en comparación con una inyección de muestra, durante un experimento entra en contacto con la columna un volumen significativamente mayor de la fase móvil y que, si hay partículas presentes, podrían acelerar y exacerbar los efectos de obstrucción de la columna observados.
Factores que influyen en la retención en la membrana de filtración
La filtración de las muestras y las fases móviles se realizó utilizando membranas de filtración que actúan como barreras microporosas. Los poros de las membranas son responsables de la exclusión por tamaño físico de las partículas de una matriz a granel. Sin embargo, pueden surgir ciertas situaciones en las que es posible que atraviesen la membrana partículas de tamaño mayor al tamaño de poro previsto o indicado, o que no atraviesen la membrana partículas más pequeñas, lo que provoca resultados de retención variados.
Las diferentes características de los poros de un microfiltro, como la forma, el tamaño, la frecuencia, la distribución y la simetría, definen cómo el filtro retendrá ciertos tamaños de partículas. En este estudio de retención de filtros, diferentes filtros de PTFE del mismo tamaño de poro, especialmente poros de 0,2 µm, de diferentes fabricantes demostraron retención variable de las mismas partículas. Esto puede deberse a que la distribución del tamaño de los poros y la porosidad son más amplias o más estrechas de un fabricante a otro. En otras palabras, el rango de tamaños de poro, de más pequeño a más grande puede ser muy diferente. El proceso de preparación de las membranas, incluso del mismo material, varía de un proveedor a otro. Por lo tanto, la forma del poro resultante puede variar mucho de un material a otro y, a veces, de lote a lote, en especial si el proceso no se controla cuidadosamente. Además, los fabricantes tienen diferentes formas de medir la porosidad y el tamaño de los poros, que pueden basarse en pruebas como la permeabilidad al aire, el punto de burbuja, la permeabilidad al agua purificada, el análisis de BET, la porometría o la retención.
Cuando se utilizan filtros de jeringa para la preparación de muestras para (U)HPLC y LC-MS, la retención de partículas no es la única característica que debe tenerse en cuenta. Otros aspectos de la membrana, como su química y su compatibilidad química, el diámetro, el espesor y la carcasa, así como las características químicas de la disolución y el analito que vayan a filtrarse pueden tener también un impacto significativo en el rendimiento general de la membrana de filtración.13
Filtración, obstrucción de las columnas y análisis mediante HPLC
Filtrar las muestras antes de la (U)HPLC se considera una buena práctica.5 Esto evita la obstrucción prematura de la columna y el aumento de la contrapresión del instrumento, lo que a su vez evita el paro innecesario del sistema y la pérdida de productividad del laboratorio, al tiempo que mantiene la calidad de los datos. Los resultados de los estudios de eficiencia de retención indican que los filtros de jeringa pueden variar en cómo protegen las columnas cuando se utilizan para filtrar muestras que contienen partículas antes de la inyección para (U)HPLC.
Los filtros de jeringa del mismo tamaño de poro pueden tener diferentes eficiencias de retención de partículas. Es importante seleccionar un filtro que retenga de manera eficiente las partículas para proteger la columna de (U)HPLC de una obstrucción prematura. Las fases móviles también deben filtrarse porque las partículas no solo causan obstrucción de la columna, sino que también pueden provocar el fallo de los componentes del equipo con el tiempo. Por lo tanto, para proteger la vida útil de la columna de HPLC y producir datos de alta calidad constante, siempre debe considerarse la filtración tanto de la muestra como de la fase móvil.
Referencias bibliográficas
Para seguir leyendo, inicie sesión o cree una cuenta.
¿No tiene una cuenta?