Évaluation des filtres pour seringue Millex® utilisés pour l'analyse des impuretés nitrosamines dans les médicaments pharmaceutiques
Analyse des impuretés nitrosamines
La détection et la quantification des nitrosamines présentes dans les médicaments sont indispensables pour assurer la sécurité et la qualité des produits pharmaceutiques. Générées lors des procédés de synthèse via différentes voies difficiles à prévoir, les impuretés chimiques de type nitrosamine semblent posséder des propriétés cancérogènes et génotoxiques, ce qui représente un risque pour la santé des patients1-4. Leur présence a été détectée dans plusieurs substances médicamenteuses et excipients de médicaments, conduisant à de nombreux rappels depuis 2018, dont celui du valsartan5,6.
Exigences réglementaires pour l'analyse des nitrosamines
Les agences et organismes de réglementation pharmaceutique tels que la Food and Drug Administration (FDA) des États-Unis, l'Agence européenne des médicaments (EMA) et le Conseil international d'harmonisation des exigences techniques pour l'enregistrement des médicaments à usage humain (ICH) ont établi des lignes directrices et des exigences concernant la présence de nitrosamines dans les produits pharmaceutiques. Un résumé de leurs points clés est présenté dans le Tableau 1.
Ces autorités réglementaires contrôlent et actualisent activement leurs lignes directrices concernant les impuretés nitrosamines afin de préserver la santé et la sécurité des personnes. Les fabricants de produits pharmaceutiques doivent impérativement respecter ces lignes directrices et ces exigences lors de l'évaluation et de l'atténuation des risques de contamination des médicaments par les nitrosamines.
Méthodes d'analyse des nitrosamines
Les agences réglementaires mondiales telles que l'EMA, la FDA des États-Unis et autres, ont rappelé l'importance de l'utilisation de méthodes analytiques fiables pour l'analyse des nitrosamines dans les produits pharmaceutiques. La LC-MS/MS est une méthode analytique couramment recommandée par les agences réglementaires pour l'analyse des nitrosamines. Grâce à la séparation par chromatographie liquide haute performance (HPLC) combinée à la détection par spectrométrie de masse en tandem (MS/MS), les analyses sont à la fois très sensibles, sélectives et précises. La LC-MS/MS permet de détecter et de quantifier différentes nitrosamines à l'état de traces dans des matrices d'échantillons complexes. Elle est donc idéale pour les analyses de routine tout en respectant les limites imposées par la réglementation. Le chapitre général de la pharmacopée américaine (USP) <1469> (procédure 3) utilise la LC-MS/MS pour la quantification des nitrosamines13. La FDA des États-Unis, la Pharmacopée européenne14, la Health Sciences Agency (HSA) de Singapour15 et la Food and Drug Administration de Taïwan16 ont également publié des méthodes de LC-MS/MS pour la détermination des nitrosamines dans la ranitidine et dans d'autres médicaments.
La HPLC couplée à la spectrométrie de masse à haute résolution (HPLC-HRMS ou LC-HRMS) est une autre technique clé pour l'analyse des nitrosamines. La sélectivité de cette méthode a permis de différencier les impuretés semblables aux nitrosamines des nitrosamines réelles, assurant ainsi la fiabilité des résultats des tests. La FDA a développé et validé des méthodes de LC-HRMS17. Le chapitre général de la pharmacopée américaine (USP) <1469> (procédure 1) présente également cette méthode.7
La HPLC avec détection par UV-visible est également utilisée pour l'analyse des nitrosamines. Bien que sa sensibilité soit inférieure à celle de la LC-MS/MS, elle peut être utilisée comme méthode rapide pour l'analyse des matières premières, des solvants ou des excipients. L'Agence nationale de sécurité du médicament et des produits de santé (ANSM) dispose de deux méthodes basées sur la HPLC-UV18,19.
La chromatographie en phase gazeuse couplée à la spectrométrie de masse en tandem (GC-MS/MS) est une autre méthode couramment utilisée pour l'analyse des nitrosamines. Elle offre une sensibilité et une spécificité excellentes pour la détection des nitrosamines et se révèle particulièrement utile pour la détection des nitrosamines volatiles. Le chapitre général de la pharmacopée américaine (USP) <1469>10, la FDA de Taïwan13 et Swissmedic20 utilisent des méthodes GC-MS/MS pour l'analyse des nitrosamines, tandis que la Health Sciences Agency (HSA) de Singapour a publié une méthode basée sur le couplage chromatographie en phase gazeuse-spectrométrie de masse haute résolution/masse exacte (HRAM-GCMS)21.
Exigences en matière de filtration des échantillons pour l'analyse des nitrosamines
La plupart des méthodes mentionnées ci-dessus nécessitent une filtration des échantillons avant l'injection. La filtration constitue la méthode la plus simple pour éliminer les particules présentes dans les échantillons et les phases mobiles avant l'injection, lesquelles peuvent nuire considérablement aux performances d'un instrument HPLC. La présence de particules est très fréquente dans les produits pharmaceutiques tels que le valsartan, en raison du procédé de dissolution de la formulation. La dimension des pores d'un filtre membrane définit le degré de rétention des particules dans un échantillon ; pour les méthodes HPLC, la dimension courante est de 0,45 µm. Lors de l'utilisation de colonnes remplies de petites particules (p. ex., particules de moins de 2 µm) et pour l'UHPLC, il est recommandé d'utiliser un filtre de 0,2 μm. Les filtres membranes de même dimension de pores ne présentent pas toujours la même efficacité de rétention, comme le démontre une étude antérieure22.
Le Tableau 2 énumère les étapes de filtration des différentes méthodes publiées par les agences de réglementation du monde entier. Les filtres pour seringue sont privilégiés pour les méthodes d'analyse des nitrosamines. Le matériau du filtre membrane et la dimension des pores sont deux caractéristiques importantes des filtres pour seringue. Les matériaux de filtre membrane le plus couramment utilisés dans les méthodes d'analyse publiées sont le PVDF et le PTFE ; le nylon et le polypropylène hydrophile (p. ex., la membrane GHP) sont également cités dans certains cas (Tableau 2). Les dimensions de pores utilisées dans les méthodes sont 0,2 µm, 0,22 µm et 0,45 μm.
Méthodes expérimentales
Une méthode figurant dans le chapitre général de la pharmacopée américaine (USP) <1469> (Procédure 3) et validée précédemment a été utilisée lors de cette étude31. La partie 1 étudie les impuretés nitrosamines extractibles des dispositifs de filtration pour seringue ; la partie 2 étudie quant à elle la récupération à l'aide de valsartan enrichi. Les conditions de LC-MS/MS sont indiquées dans le Tableau 3 et les transitions MRM sont indiquées dans le Tableau 4.
Filtres pour seringue testés. Trois dispositifs pour deux lots de (1) Millex® PVDF 0,22 µm et (2) Millex® PTFE 0,2 µm et trois dispositifs pour un lot de (3) Vendeur P PVDF 0,2 µm, (4) Vendeur C H-PTFE 0,2 µm, (5) Vendeur M PVDF 0,2 µm, et (6) Vendeur M PTFE 0,2 µm ont été testés.
Partie 1 - Extractibles. Pour déterminer la présence de taux de référence d'impuretés nitrosamines extractibles dans les filtres pour seringue, un échantillon de diluant uniquement (acide formique 0,1 % v/v dans de l'eau) a été enrichi avec quatre étalons internes (EI) marqués isotopiquement conformément au chapitre général de la pharmacopée américaine (USP) <1469> [10 µg/ml pour la NDMA-d6 et la NMBA-d3 et 1 µg/ml pour la NDEA-d10/NDBA-d18]. Les échantillons ont été soumis à un vortex, centrifugés (10 000 tours/minute pendant 10 minutes) et le surnageant a été filtré à l'aide de filtres pour seringue de 13 mm. Le filtrat a été analysé pour six composés de nitrosamine par LC-MS/MS. Les concentrations ont été déterminées à l'aide d'une courbe d'étalonnage externe allant de 1,33 à 90 ng/ml (NDMA, NMBA, NEIPA, NDIPA et NDBA) et de 0,66 à 69,4 ng/ml (NDEA).
Partie 2 - Récupération. 40 mg de valsartan dura (dose de 80 mg) ont été pulvérisés, dilués avec de l'acide formique à 1 % dans de l'eau, puis enrichis à une concentration faible (L2) conformément au chapitre général de l'USP <1469>. L'échantillon a ensuite été centrifugé, filtré et analysé par LC-MS/MS.
Évaluation des filtres pour l'analyse des nitrosamines
La filtration des échantillons avant leur injection intervient dans de nombreuses méthodes basées sur la LC-MS et la GC-MS pour la recherche d'impuretés nitrosamines. L'absence d'extractibles dans les dispositifs de filtration est essentielle pour maintenir la précision et la cohérence des données dans ces méthodes. Des études de récupération doivent également être effectuées, étant donné que certaines molécules peuvent se lier aux composants d'un filtre pour seringue, ce qui peut affecter la qualité des données générées.
Une méthode validée basée sur le chapitre général de la pharmacopée américaine (USP) <1469> (Procédure 3) a été utilisée pour évaluer les filtres pour seringue27. Cette méthode de l'USP décrit l'utilisation de la LC-MS/MS pour la quantification de la NDMA, de la NDEA, de la NDIPA, de la NEIPA, de la NMBA et de la NDBA dans les sartans sélectionnés (valsartan, losartan potassique, olmésartan médoxomil, candésartan cilexétil et telmisartan). La dernière partie de la sous-section "Solution d'échantillon" de la méthode exige une filtration "à l'aide d'un filtre en polytétrafluoroéthylène (PTFE) hydrophile d'une dimension de pores de 0,45 μm" après centrifugation11.
Partie 1 – Extractibles
Le filtrat obtenu lors de l'étape de filtration sur seringue a été analysé pour déterminer les extractibles de nitrosamine à l'aide d'une courbe d'étalonnage externe allant de 1,33 à 90 ng/ml (NDMA, NMBA, NEIPA, NDIPA et NDBA) et de 0,66 à 69,4 ng/ml (NDEA). La Figure 1 est un exemple de chromatogramme MRM de ces composés.
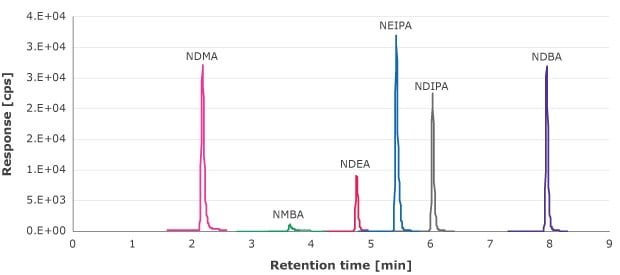
Figure 1.Chromatogramme MRM des solutions étalons de nitrosamine. (10 ng/ml pour la NDMA, la NMBA, la NEIPA, la NDIPA et la NDBA et 6,6 ng/ml pour la NDEA)
La limite de quantification (LQ) est définie comme la concentration qui permet d'obtenir un rapport signal/bruit de 10. La concentration la plus faible des courbes d'étalonnage pour chaque impureté nitrosamine analysée présentait un rapport signal/bruit (S/N) supérieur à 10. Aucune nitrosamine n'a été détectée à un niveau supérieur ou égal à cette valeur dans les filtres pour seringue testés (Tableau 5).
ABRÉVIATIONS : PVDF = poly(fluorure de vinylidène) hydrophile ; PTFE = polytétrafluoroéthylène hydrophile ; LQ = limite de quantification ; ND = non détecté
Il est essentiel de s'assurer que les dispositifs de filtration ne contiennent aucune substance chimique extractible susceptible de nuire à la qualité des données, en particulier dans le cas des méthodes faisant appel à des instruments très sensibles. Les extractibles doivent être évités, car ils peuvent co-éluer avec les pics de l'analyte ou se manifester sous forme de pics inattendus dans les analyses en aval, rendant l'interprétation des données plus difficile. Les extractibles peuvent provenir du filtre, de produits chimiques résiduels issus du procédé de fabrication ou de produits chimiques secondaires rejetés par le filtre. Dans le cas d'analytes spécifiques tels que les composés de nitrosamine, des extractibles peuvent être formulés par inadvertance au cours du coulage de la membrane.
Partie 2 - Récupération du valsartan
L'étude de récupération a été réalisée par enrichissement de l'échantillon de valsartan avec des étalons de référence à un niveau de concentration faible (L2). Les solutions d'échantillons préparées ont été analysées par LC-MS/MS, sur la base d'une courbe d'étalonnage externe pour calculer la concentration de chaque analyte. Le rapport entre le signal de l'étalon interne et le signal de l'analyte (p. ex., signal pour la NDMA-D6/signal pour la NDMA) a été déterminé dans la solution d'échantillon et dans les solutions d'étalonnage externe.
Le Tableau 6 présente la récupération moyenne pour les filtres pour seringue en PVDF et en PTFE testés. Tous les taux de récupération des composés étaient compris dans une plage acceptable de 70 à 130 %31 pour tous les dispositifs et matériaux testés, avec quelques différences mineures évidentes entre les composés et les matériaux du filtre. Par exemple, la NDBA a montré des taux de récupération comparativement faibles (tout en restant dans la plage acceptable), ce qui pourrait résulter de ses interactions hydrophobes avec le média filtrant ou les ingrédients du produit pharmaceutique. Les filtres pour seringue Millex® hydrophiles en PVDF et en PTFE ont montré des taux de récupération constants d'un lot à l'autre.
Lors du choix des matériaux du filtre pour seringue, l'adsorption des molécules d'analyte par le dispositif de filtration doit également être prise en compte, car cette dernière peut entraîner un taux de récupération insuffisant. Les propriétés physico-chimiques du dispositif de filtration (le filtre membrane et le support) et la chimie de l'analyte déterminent l'étendue de l'adsorption. Diverses interactions secondaires, telles que les interactions électrostatiques, la liaison hydrogène et les interactions hydrophobes, contribuent à l'adsorption de l'analyte par le filtre membrane et sa fixation au support32. Dans cette étude, les taux de récupération relativement plus faibles pour la NDMA avec les filtres membranes en PVDF et PTFE (toujours compris dans une plage acceptable) pourraient être le résultat d'interactions hydrophobes entre la NDMA et la membrane. La NDIPA a présenté des taux de récupération plus faibles avec les membranes en PVDF, suggérant que la molécule peut interagir différemment avec les polymères PTFE et PVDF. Les autres polymères dotés de groupes fonctionnels polaires et de tendances à la l'adsorption non spécifique plus élevées (par exemple le nylon), sont susceptibles de présenter une adsorption plus élevée, entraînant davantage de pertes d'analytes. Pour optimiser la précision des récupérations, un rejet du premier ml de filtrat lors de la préparation de l'échantillon est donc suggéré, conformément à la recommandation formulée dans les méthodes de la FDA des États-Unis pour la recherche de nitrosamines23,24. Ainsi, la saturation des sites de liaison en analyte est assurée et aucune perte supplémentaire d'analyte ne survient. Nous avons également observé ce phénomène pour des matériaux de membrane à fort pouvoir d'adsorption, tels que le nylon.
Analyse des impuretés nitrosamines et sélection des filtres
Tous les filtres pour seringue en PVDF et PTFE testés ont montré des taux d'extractibles de nitrosamine inférieurs à la limite de quantification conformément au chapitre général de la pharmacopée américaine (USP) <1469> (Procédure 3). En outre, ils ont tous enregistré des taux de récupération acceptables pour les nitrosamines enrichies ; seules des différences mineures ont été constatées entre les différents composés. Ces résultats démontrent que ces médias filtrants conviennent à la préparation d'échantillons pour les méthodes d'analyse des nitrosamines.
Applications apparentées
- Analyse et contrôle qualité (QC) de petites molécules
Au cours du développement des médicaments, il est essentiel que les méthodes d'analyse et le contrôle qualité (QC) des petites molécules respectent les spécifications des pharmacopées internationales. La chimie analytique et les contrôles microbiens permettent de s'assurer que les petites molécules sont développées et fabriquées conformément aux Bonnes pratiques de fabrication (BPF).
- Tests des pharmacopées et recommandations réglementaires
Les tests des pharmacopées sont essentiels à la libération des excipients et des produits médicamenteux. Les pharmacopées internationales, comme l'USP et la Ph. Eur., ont établi des normes de qualité. Les ingrédients pharmaceutiques et les médicaments doivent impérativement respecter les tests qui figurent dans ces normes et qui sont détaillés dans les méthodes officinales.
Références bibliographiques
Pour continuer à lire, veuillez vous connecter à votre compte ou en créer un.
Vous n'avez pas de compte ?