离子液体的储能应用
John D. Stenger-Smith1, Jennifer A. Irvin2
1Naval Air Warfare Center, Weapons Division, China Lake, CA 93555 , 2Texas State University, San Marcos, TX 78666
Material Matters 2009, 4.4, 103.
简介
离子液体,又叫室温离子液体,是在室温或接近室温下呈现液态的有机盐。这种盐(图1)由于极低的挥发性和对多种化合物的溶解性已成为广受关注的对象;这两种性质的结合使离子液体可作为“绿色”溶剂用于能源应用和工业过程。

图 1.离子液体常见阳离子和阴离子
一些离子液体另一有用的特性是较宽的电化学稳定性窗口,可以高达6.0 V。1 这一窗口使得这些离子液体成为电化学电解液的有力候选。用作电解液的材料有大电压窗口是可取的,但它们可能还具有不可接受的高粘度和过低的电导率。高粘度经常导致更高的氧化电位(由于质量传输速率降低)和更长的反应时间。 2 表1对一些离子液体电解液(ILE)的解读清楚表明了这种性质交换。
因ILE的到来而显著受益的一个领域是电活性聚合物。电活性聚合物(Electroactive polymers,EAP)随着电导率、颜色和体积等性质变化可在两种或更多稳定氧化状态之间切换。颜色改变导向电致变色应用,例如显示器和自动调光窗,体积改变导向机电驱动器应用,例如人工肌肉和微机电系统(MEMs)。过去三十年包含EAP的装置一直是集中研究的重点。由于这种聚合物具有在中性、p型掺杂氧化态和n型掺杂还原态之间转换的可能性,因此可以有各种电极配置。体现于电活性聚合物可用于电化学电容器、3可再充电电池4和电致变色装置。5 图2显示EAP发生的常见氧化和还原反应。
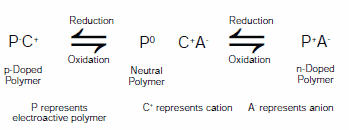
图 2.在电解液(C+A-)存在下,电活性聚合物(P)在n型掺杂、中性和p型掺杂状态之间切换的一般反应图解
如图2所示,EAP的氧化、中和与还原需要离子运动以遵守电荷守恒。选择离子可以影响形态、稳定性及氧化和还原电位。6 通过使用电解质溶液例如四烷基铵盐水溶液、乙腈或碳酸丙烯酯(货号310328)引入离子。图1所示离子液体作为EAP系统的替代电解液受到了极大关注。它们可以纯粹形式或联合其他溶剂使用。7-9 ILE的优势包括广泛的温度使用窗、低挥发性及良好的电化学性和热稳定性。10 相对溶液型电解液来说,使用时没有添加额外溶剂的离子液体电解液显著提高EAP型装置的转换稳定性。11
离子液体的超级电容器和电池应用
电化学电容器(超级电容器)
电化学电容器(EC),又称作超级电容器,是功率平衡的电荷储存装置,使用电活性聚合物的氧化还原、金属氧化物或碳质材料储存电能。充电过程中,EC电极被还原(阴极)和被氧化(阳极)来储存电能,之后在放电过程中电能被释放,电极材料则回到中性状态。图3解释了IV型EC的一般运行,结合p型掺杂(阳极)和n型掺杂(阴极)聚合物以达到最高储能。

图 3.以电活性聚合物为基础的电化学容器原理图显示充电(左)和放电(右)期间的电子流动和离子运动。充电期间,阴极(n掺杂)聚合物带负电,电解液中阳离子进入电极补偿电荷。同时,阳极(p掺杂)聚合物带正电,电解液中阴离子进入电极补偿电荷。放电期间,两极聚合物都回到中性状态,离子也回到溶液。
EC最重要的应用包括便携式电子产品的内存保护系统、电力设施的负荷平衡和电动汽车储能。EC通常比电池提供更多的单位质量功率并且比传统电容器储存更多的单位质量能量。因此,它们可用于提供电动汽车的突发功率。所有EC都需要电解液才能运行;使用离子液体7,12后可以弃用挥发性有害溶剂并提高这些装置的运行稳定性。
锂离子电池
锂离子电池在电子消费市场到处可见,最终可能主导商用大型高功率储能。锂电池由电解液分隔的嵌锂氧化物和碳两种电极组成(图4)。随着电池充电,锂离子从氧化电极移动到碳电极,储存电能。当电池放电时,锂离子回到氧化电极,于是电能被释放。锂离子传输由电解液协助,它通常含有易挥发易燃溶剂。因此,安全性是含有传统电解液的锂电池的主要考虑事项。易燃溶剂存在下,短路或局部过热会导致热失控、起火甚至爆炸。离子液体替代易燃溶剂提高了电池安全性,对锂离子电池特别有用。10

图 4.显示锂离子电池在放电(左)和充电(右)期间的电子流动和锂离子运动。
此外,与电化学电容器电解液不同,离子电池电解液必须协助锂离子传输、在高负电位下保持稳定和支持电池的稳定运行。离子液体满足这些要求是可能的,有好几个研究团队正在研究这个领域。10,13 试验过的离子液体包括N-丁基-N-乙基吡咯烷双(三氟甲基磺酰基亚胺)(货号38894);乙基甲基咪唑啉双(三氟甲基磺酰基亚胺)(货号711691);N-甲基-N-丙基吡咯烷双(三氟甲基磺酰基亚胺)和N-甲基-N-丙基哌啶双(三氟甲基磺酰基亚胺)。以上任何一种都可用于制备双(三氟甲烷)磺酰亚胺锂盐溶液(货号 544094),其中锂离子是活性材料。
极端温度下的离子液体
随着对能源生产和储存的日益关注,对广泛温度下运行的电荷储存装置的需求也在增长。在汽车行业,电荷储存装置理想情况下可在低至-30°C的温度下运行。14 电荷储存装置的军用要求甚至更严格,某些应用的目标温度低至-60°C。15 大多数电池在较低温度下遭遇性能严重下降,尤其是-60°C以下。16 除了减慢充电/放电过程的动力学之外,较低温度也会增加电解液粘度,降低电解液输送电荷的能力。这样的性质变化导致装置性能下降或长时间暴露于低温时故障。低温对溶液电解液最严重的影响之一是降低电解液材料的溶解度,导致盐沉淀和电化学电容器或电池的损坏。根据表1的证据显示,许多离子液体电解液能在汽车行业要求的适度低温下运行,但很少能在军用所需的极低温度下运作。17 更挑战的是这些电解液要在同样的宽温度区间支持各种单体/聚合物体系的电化学过程(沉积、氧化、还原、装置运行15等)。不幸的是,只有少数ILE在极低温度下保持液态,而它们的粘度对大多数电化学应用而言会变得过高。混合不同离子液体或使用降粘剂可以帮助缓解这个问题。电化学装置在高达60°C的高温下的性能也是能量储存工业中的关注点。14 不幸的是,大多数溶剂型电解液在高温下会遭遇溶剂高挥发性。溶剂蒸发在密封系统中会导致起火和爆炸;而在开放系统中,它会导致电解液沉淀、电荷储存材料损坏以及电荷储存能力损失。因此,离子液体极低的挥发性使其成为用于高温的电解液的优异选择。
其他应用
离子液体还在其他很多应用中表现出潜力。较宽的电化学窗口和较低的蒸气压使它们用于电镀金属和半导体比较有利。18 离子液体也是用于高温燃料电池的潜力使能技术。19 当温度超过100 °C,水不能作为溶剂时,离子液体为传统水溶液质子传递系统提供绝佳替代品。利用电活性或离子交换聚合物的电化学驱动器需要电解液协助驱动;离子液体已被证明能增强这些装置的长期稳定性。20 使用离子液体增强稳定性最突出的例子可能是电致变色装置,当1-丁基-3-甲基咪唑四氟硼酸盐(货号711748)用作聚苯胺电致变色显示器的电解液时,电活性在100万循环后没有可观察到的重大损失。10
纯度要求
储能应用中电解液的纯度对于电化学装置的稳定性和性能十分重要。离子液体也不例外。根据离子液体制备所用的合成路线,材料中的杂质可能包括水、多余阳离子或阴离子、或其他溶剂。就算痕量污染物也会导致不良副反应并影响EAP型装置的性能。因此,氯化物和水杂质已证明会影响离子液体的粘度。21, 22 微量(几ppm)溶剂例如氧化铝和二氧化硅也会导致电化学性能损失。23 生产适合电化学使用的离子液体的纯化方法通常涉及柱层析或真空蒸馏(以去除挥发杂质;离子液体本身不会蒸发)。许多使用常用材料的方法已经发表,应该认真遵守。21-23
概要和结论
许多离子液体极低的挥发性和良好的电化学稳定性使它们成为储能装置电解液的理想选择。对于电化学应用,建议严格纯化。使用离子液体电解液的装置具有出色的电化学稳定性。极端温度下的运行能力是离子液体电解液的独有特性,这使它们成为电动汽车和其他应用的潜力候选。
致谢
J. Stenger-Smith感谢海军研究办公室(尤其是Drs.M. Anderson、P. Armistead和R. Carlin)和Power Sources Strategic Technology Initiative办公室的支持。J. Irvin感谢海军研究办公室、美国化学会石油研究基金和Welch基金会的支持。作者共同感谢Mr. Andrew P. Chafin、Dr. David J. Irvin、Dr. Andrew Guenthner和Dr. Mariem Rosario-Canales的讨论帮助。
文中观点仅代表作者观点,不一定代表国防部或其组成部门的观点。
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?