最新的空气、湿度和热稳定型交叉偶联复合物
Buchwald预催化剂发展简介
在过去的十年中,Buchwald课题组已从相应的联芳基膦配体家族中开发出了一系列高活性和多功能的钯预催化剂。这些化合物常被称为Buchwald预催化剂和配体,并已成为通过交叉偶联反应形成C-C、C–N、C–O、C–F、C–CF3和C–S键的一组高价值工具。1,2,3,4 这些富电子配体高度可调,以提供具有多种范围、高稳定性和反应性的催化剂体系。
最新一代的Buchwald预催化剂是空气、湿度和热稳定的,并在常用的有机溶剂中显示出了良好的溶解性。通常在交叉偶联反应中使用这些预催化剂可使研究人员使用较低的催化剂负载量并缩短反应时间。另外,它们的使用也确保了一般不含有还原剂的活性催化物质的有效快速生成,并使得精确控制配体与钯的比率成为可能。预催化剂的独特功能已导致了使用传统Pd来源不可行的新方法的发现。1,2

图 1.持续改善活化难度的四代Buchwald预催化剂。
第一代(G1)Buchwald预催化剂只需用碱去质子化,使得活性Pd(0)的生成更为简单。所得到的催化剂活性很高,即便是在低至-40 °C的温度下。第二代(G2)用联苯基配体取代了(G1)复合物的苯乙胺基骨架。这一改进使得研究人员能够在室温下用弱磷酸盐或碳酸盐碱生成活性Pd物质。这些催化剂被证明可以用于Suzuki-Miyaura偶联反应的各类底物。然而,较早期的催化剂在其合成或应用范围上都受到了很大的限制。通过采用更具吸电子性、非配位的甲磺酸盐来替代预催化剂中的氯离子,可以得到第三代(G3)预催化剂,其具有最强的多功能性并能够容纳体积庞大的配体,如BrettPhos (718742)等。此外,这些催化剂在溶液中展现出了很长的寿命。

图 2.Buchwald G3预催化剂
在活化过程中,G3预催化剂在脱保护后会得到Pd-酰胺基复合物,其随后可被还原消除以生成活性LPd(0),一种甲磺酸盐和咔唑。在某些罕见的情况下,咔唑会通过消耗宝贵的反应原料来抑制催化作用,并使后处理/纯化工作复杂化。此外,痕量残留的伯氨基联苯也可能在药物应用中构成潜在的健康风险。为了避免这些问题,Buchwald课题组通过将联苯骨架的氨基进行了甲基化而对G3催化剂进行了改进。这些第四代(G4)预催化剂在交叉偶联反应中展现出了更高的溶解性,并维持了极佳的催化活性。

图 3.Buchwald G4预催化剂
G3和G4 Buchwald预催化剂相对于早期的优势
- 活性Pd(0)催化剂的定量生成
- 适用于更宽范围的配体
- G3催化剂可兼容BrettPhos家族以及极为庞大的t-Bu膦类化合物
- 相对于G1和G2预催化剂在溶液中具有更强的稳定性
- G4预催化剂会生成更少的侵入性N-甲基咔唑副产物
代表性偶联应用和反应范围
G3和G4预催化剂均可有效用于不稳定硼酸的Suzuki-Miyaura偶联,而不稳定的硼酸通常容易发生去质子脱硼化。该偶联过程的成功依赖于极为快速的预催化剂活化以及高水平的催化活性。XPhos Pd G3预催化剂(763381)可在温和的条件下(rt至40°C)以较短的反应时间(30分钟)以及较高的收率将不稳定的硼酸与富含电子的位阻和杂芳基氯化物进行偶联。类似地,XPhos Pd G4预催化剂(804274)可成功地以极高的收率提供联芳基。

方案 1.XPhos Pd G3和G4预催化剂介导的Suzuki-Miyaura偶联反应
高度活化的XantPhos Pd G4 (900329)预催化剂适用于(杂)芳基溴化物的低温氨基羰基化反应,以极高的收率合成挑战性产物,而反应原料CO仅有少许过量。

方案 2.使用XantPhos Pd G4进行(杂)芳基溴化物的氨基羰基化。
EPhos Pd G4 (901220)是在合成官能团化4-芳基氨基噻唑和2-芳基氨基恶唑时,钯催化的伯胺和芳基卤化物之间C-N交叉偶联所选择的预催化剂。

方案 3.2-芳基氨基恶唑与芳基卤化物的EPhos Pd G4催化交叉偶联。
VPhos Pd G4 (901218)与辛酸/辛酸钠表面活性剂体系一起可用于从烷基锌试剂快速合成多种烷基化骨架。它常用于催化卤代烷与芳基亲电子试剂的Lipshutz–Negishi交叉偶联反应。

方案 4.卤代烷与芳基亲电子试剂的VPhos Pd G4催化交叉偶联。
(t-Bu)PhCPhos Pd G3 (900534) 是一种杂(烷基)芳基连接的预催化剂,常优选用于高度受阻的α,α,α-三取代伯胺与各种(杂)芳基氯化物和溴化物的芳基化反应。
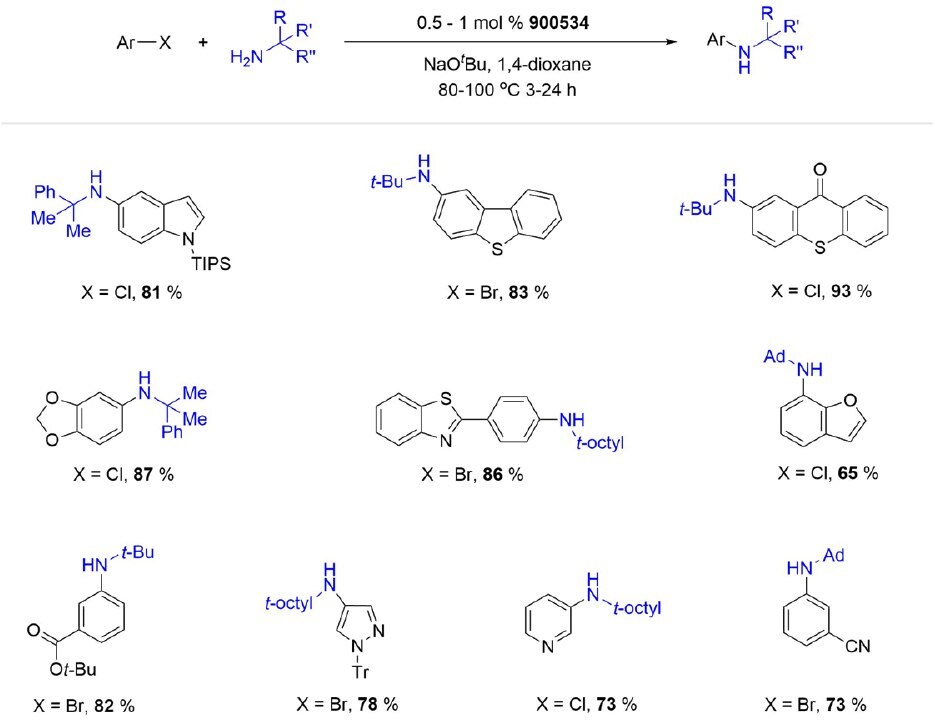
方案 5.受阻伯胺的(tBu)PhCPhos Pd G3催化芳基化反应
RockPhos Pd G3预催化剂(773905)已被证明可用于C–O键的形成,从而可以较高至极高的收率将伯脂肪族醇与芳基卤化物进行偶联。

方案 6.芳基卤化物与伯醇的RockPhos Pd G3催化C-O交叉偶联。

方案 7.伯胺和仲胺的BrettPhos Pd G3和G4催化芳基化反应。
均匀庞大的tBuBrettPhos Pd G3预催化剂(745979)可极高效地用于伯酰胺的芳基化并具有较好的官能团耐受性。该催化剂易于使酰胺芳基化,但能抵抗所研究底物中吲哚和未保护醇基的竞争性芳基化作用。此外,这种多功能的钯预催化剂是芳基卤化物与多种伯醇、甲醇和乙醇进行C-O交叉偶联的绝佳选择。有趣的是,它还能够让氢氧化钾和氢氧化铯与(杂)芳基卤化物发生交叉偶联,并以较好至极佳的收率生成羟基化的杂芳烃。

方案8.a.酰胺的tBuBrettPhos Pd G3催化芳基化反应

方案8.b.(杂)芳基溴化物的tBuBrettPhos Pd G3催化氨基羰基化反应

方案8.c.芳基和杂芳基卤化物的tBuBrettPhos Pd G3催化羟基化反应

方案8.d.伯醇的tBuBrettPhos Pd G3催化C-O交叉偶联反应
带有庞大金刚烷部分的AdBrettPhos Pd G3 (776106)是一种高效的预催化剂,可将多种五元杂芳基卤化物进行选择性胺化以合成多种氨基取代的吡唑、苯并噻唑、吲唑和咪唑。

方案 9.氨与五元杂芳基卤化物的AdBrettPhos Pd G3催化芳基化反应。
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?