Przegląd glikanów N-linkowych
N-linked glycosylation Wprowadzenie
N-linked glycosylation, modification, and degradation are involved in a wide variety of processes in all organisms from archaea to eukaryota. Jest to najczęstsza kowalencyjna modyfikacja białek w komórkach eukariotycznych. Żadna inna potranslacyjna modyfikacja białek nie jest tak złożona chemicznie i nie pełni tak wielu różnorodnych funkcji.
Struktury
Wszystkie N-linkowane glikany oparte są na wspólnym rdzeniu pentasacharydowym, Man3GlcNAc2 (Rysunek 1). Dalsze przetwarzanie w golgim skutkuje trzema głównymi klasami glikanów N-linkowych:
- Wysoka mannoza
- Hybryda
- Kompleks

Rysunek 1. Podstawowa struktura dla wszystkich glikanów N-linkowych.
Glikany o wysokiej zawartości mannozy zawierają niepodstawione końcowe cukry mannozowe (Rysunek 2). Glikany te zazwyczaj zawierają od pięciu do dziewięciu reszt mannozy przyłączonych do rdzenia chitobiozy (GlcNAc2). Skróty nazw wskazują na całkowitą liczbę reszt mannozowych w strukturze.

Rysunek 2. Przykłady glikanów o wysokiej zawartości mannozy Man-5 (góra) i Man-9 (dół).
Glikany hybrydowe charakteryzują się tym, że zawierają zarówno niepodstawione końcowe reszty mannozy (obecne w glikanach o wysokiej zawartości mannozy), jak i podstawione reszty mannozy z wiązaniem N-acetyloglukozaminy (obecne w złożonych glikanach) (Rysunek 3). Te sekwencje GlcNAc dodane do rdzenia glikanu związanego z N w hybrydowych i złożonych N-glikanach nazywane są "antenami". Najwyższa struktura pokazana na Rysunku 3 to biantenowy glikan z dwiema gałęziami GlcNAc połączonymi z rdzeniem. Dolna struktura to trójantenowy glikan z trzema gałęziami GlcNAc.
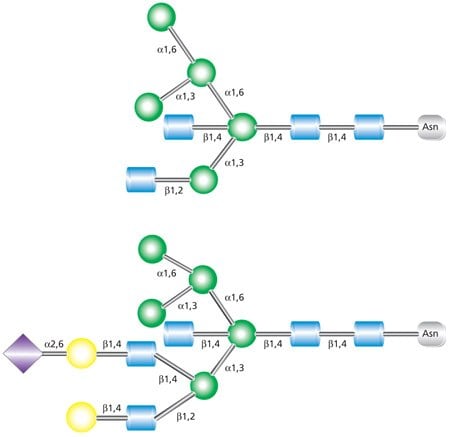
Rysunek 3. Przykłady glikanów hybrydowych dwuantenowych (u góry) i trójantenowych (u dołu).
Złożone glikany N-linkowe różnią się od glikanów o wysokiej zawartości mannozy i glikanów hybrydowych tym, że mają dodane reszty GlcNAc zarówno w miejscach α-3, jak i α-6 mannozy (Rysunek 4). W przeciwieństwie do glikanów o wysokiej zawartości mannozy, złożone glikany nie zawierają reszt mannozy poza strukturą rdzenia. Dodatkowe monosacharydy mogą występować w powtarzających się jednostkach laktozaminy (GlcNAc-β(1→4)Gal). Złożone glikany występują w formach dwu-, trzy- i czteroantenowych i stanowią większość N-glikanów wydzielanych na powierzchni komórek. Złożone glikany są zwykle zakończone resztami kwasu sialowego. Możliwe są również dodatkowe modyfikacje, takie jak dodanie dwuskładnikowego GlcNAc w rdzeniu mannozylowym (jak wskazano na Rysunku 4) i/lub reszty fukozylowej na najbardziej wewnętrznym GlcNAc.
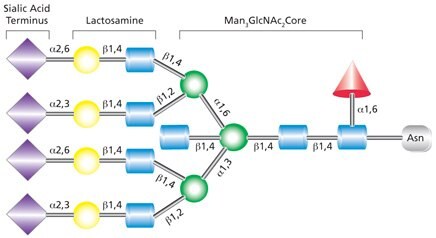
Rysunek 4. Przykład tetraantenowego złożonego glikanu, który zawiera końcowe reszty kwasu sialowego, dwusieczny GlcNAc na rdzeniu pentasacharydowym i fukozylację na rdzeniu GlcNAc.
Biosynteza i degradacja
Glikozylacja białek glikanami N-związanymi jest w rzeczywistości zdarzeniem ko-translacyjnym, zachodzącym podczas syntezy białek. N-wiązana glikozylacja zachodzi w sekwencji konsensusowej Asn-X-Ser/Thr, gdzie glikan przyłącza się do grupy aminowej asparaginy, a X reprezentuje dowolny aminokwas z wyjątkiem proliny. Glikozylacja występuje najczęściej, gdy ta sekwencja konsensusowa występuje w pętli wewnątrz peptydu.
Półprodukty oligosacharydowe przeznaczone do przyłączenia białka są syntetyzowane przez serię transferaz po cytoplazmatycznej stronie endoplazmatycznego rektulum (ER), podczas gdy są połączone z zasadą fosforanu dolicholu (P-Dol). Po dodaniu cząsteczek mannozy i N-acetylo-D-glukozaminy, zwykle przy użyciu GDP-Man i UDP-GlcNAc jako donorów glikanu, ostatecznym konstruktem przed przemieszczeniem się z cytoplazmatycznej strony ER jest Man5GlcNAc2-P-Dol (Rysunek 5).
Ten prekursor dolicholu z przyłączonym glikanem jest przesuwany do światła ER ("odwracany") w celu dalszej modyfikacji enzymatycznej. Przetwarzanie obejmuje przycinanie reszt glukozy i mannozy przez glikozydazy i dodawanie nowych reszt przez glikozylotransferazy w ER i, w dużej mierze, w Golgim. W Golgim N-glikany o wysokiej zawartości mannozy mogą być przekształcane w różne złożone i hybrydowe formy, które są unikalne dla kręgowców. Ukończony oligosacharyd jest następnie przenoszony z prekursora dolicholu do Asn białka docelowego przez oligosacharylotransferazę (OST).
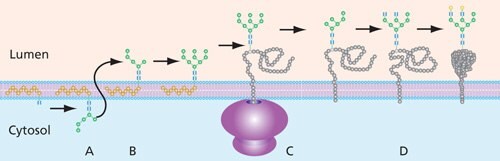
Rysunek 5. Ogólny proces budowy glikanu N-wiązanego w ER. Prekursor glikanu jest montowany na bazie fosforanu dolicholu w cytoplazmie ER (A). Po przełączeniu glikanu na stronę światła (B), glikan ma dodatkowe cukry dodawane i usuwane (przycinane) przed przyłączeniem do białka (C), gdzie następuje dodatkowe przetwarzanie (D).
Odcięte glikany o wysokiej zawartości mannozy służą jako substraty w Golgim, gdzie następuje dodatkowa modyfikacja i dywersyfikacja. Struktury o wysokiej zawartości mannozy są przycinane przez działanie mannozydaz, usuwając przedłużenia mannozy i udostępniając glikan do konwersji do hybrydowych i złożonych glikanów przez późniejsze dodanie cukrów GlcNAc ("anteny") przez działanie N-acetyloglukozylotransferaz. Gen ssaków Mgat1 koduje enzym N-acetyloglukozylotransferazę-I (GlcNAcT-I), który jest odpowiedzialny za dodanie jednego GlcNAc w wiązaniu β(1→2). Następnie zmodyfikowany glikan staje się substratem dla α-mannozydazy II, która usuwa reszty α(1→3) i α(1→6) reszt mannozy i skutkuje strukturą molekularną, która podlega donacji grupy glukozylowej przez GlcNAcT-II (N-acetyloglukozylotransferazę-II), kodowaną przez gen Mgat2 . Kataliza przez GlcNAcT-II przekształca hybrydowe glikany w formy złożone poprzez przyłączenie dodatkowych ugrupowań GlcNAc do struktury hybrydowej.
Fukozylacja w rdzeniu reszty GlcNAc po modyfikacji GlcNAcT-I zarówno w hybrydowej, jak i złożonej syntezie N-linków jest również powszechnym zjawiskiem. U kręgowców fukoza jest dodawana w wiązaniu α(1→6), podczas gdy u roślin i bezkręgowców fukoza jest dodawana w wiązaniu α(1→3).
Zahamowanie lub eliminacja glikozylacji w badaniach N-wiązanych glikanów może być spowodowana przez szereg związków. N-glikozylacja jest silnie hamowana w obecności kompaktyny, koenzymu Q lub egzogennego cholesterolu. Leczenie tunicamycyną całkowicie blokuje glikozylację, ponieważ tunicamycyna hamuje C-1-fosfotransferazę GlcNAc, enzym, który jest krytyczny w tworzeniu prekursora dolicholu.
α-mannozydaza, β-mannozydaza, sialidaza i α-fukozydaza są głównymi egzoglikozydazami zaangażowanymi w przycinanie i degradację N-łączonych glikanów. Komórki owadów wyrażają N-acetyloglukozminidazę, która rozszczepia końcowe reszty GlcNAc z glikanów N-łańcuchowych.
Funkcje
Podczas rozwoju struktury pośrednie glikoproteiny pełnią określone funkcje. We wczesnych fazach ewolucji glikoprotein, różne struktury oligosacharydów rdzeniowych są niezbędne do prawidłowego fałdowania białek i orientacji grup funkcjonalnych. Nieprawidłowo sfałdowane białka są albo reglikozylowane i ponownie fałdowane, albo deglikozylowane i degradowane. W późniejszych fazach cząsteczka oligosacharydu jest wymagana do transportu wewnątrzkomórkowego i ukierunkowania glikoproteiny w retikulum endoplazmatycznym, kompleksie Golgiego i sieci trans-Golgiego. W końcowej fazie glikan związany z N ulega rozległej modyfikacji w kompleksie Golgiego, w wyniku czego powstaje dojrzała glikoproteina.
Cząsteczka białka i przyłączone hydrofilowe glikany związane z N są względnie niezależne, mimo że są kowalencyjnie połączone, tj. glikany mogą być modyfikowane bez znaczącego wpływu na strukturę i funkcję białka. Białka mogą zawierać wiele miejsc glikozylacji, które są modyfikowane dowolną z trzech klas N-związanych glikanów. Stwierdzono, że kręgowce posiadają zróżnicowany zestaw złożonych i hybrydowych glikoprotein ze względu na szeroką gamę glikozydaz i glikozylotransferaz zakodowanych w genomie. Podczas gdy te trzy klasy glikoprotein z wiązaniami N są również obecne u niższych organizmów, istnieje mniejsza różnorodność struktury niż w glikoproteinach kręgowców.
Oprócz tego, że konkretna glikoproteina może zawierać wiele struktur glikanu, różne cząsteczki tej samej glikoproteiny mogą mieć różne struktury glikanu przyłączone do identycznego miejsca podstawienia. Modyfikacje w strukturach glikanowych zapewniają cechy identyfikacyjne różnym typom komórek i temu samemu typowi komórek na etapach rozwoju, różnicowania, transformacji, konserwacji i starzenia. Ta zmienność w glikozylacji białek jest znana jako mikroheterogenność i przyczynia się do trudności w identyfikacji i izolacji określonych glikoprotein.
Wrodzone zaburzenia glikozylacji (CDG) to seria chorób związanych z błędami metabolizmu spowodowanymi niedoborami enzymów. Większość zidentyfikowanych CDG wynika z niepowodzeń w biosyntezie lub degradacji N-glikanów z powodu braku jednego z enzymów zaangażowanych w N-glikozylację, głównie egzoglikozydowych enzymów α-mannozydazy, β-mannozydazy, sialidazy lub α-fukozydazy.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?