폴리(에틸렌 글리콜)는 네트워크로 교차결합되었을 때 높은 수분 함량을 갖는 친수성 고분자입니다. PEG는 일반적으로 면역 반응을 유도하지 않으므로 생물학적 용도에 적합한 소재입니다.6 1970년대부터 PEG는 치료용 단백질과 펩타이드를 변형하여 용해도를 높이고 독성을 낮추어 반감기를 연장하는 데 사용되어 왔습니다.7 그리고 1970년대 후반부터 PEG 하이드로겔로 세포 배양에 대한 실험을 시작했습니다. PEG 하이드로겔은 화학적으로 잘 정의된 복합 화학 물질이며 여러 화학 물질의 형성 및 화학적 변형에 모두 사용될 수 있습니다.
PEG Macromers
PEG는 에틸렌 옥사이드의 살아있는 음이온 고리열림중합 방식으로 쉽게 합성되며, 다양한 분자량 및 여러 말단기(예: 알코올, 메틸에테르, 아민, NHS(N-hydroxuscinimidyl) 에스테르)를 가진 잘 정의된 PEG가 광범위하게 이용되고 있습니다.
하이드로겔을 형성하기 위해서는 PEG가 교차결합되어야 합니다. 초기에 PEG는 이온화 방사선을 사용하여 비특이적으로 교차결합되었습니다.8 지금은 일반적으로 반응성 사슬 말단이 있는 PEG 대형 단량체의 공유 교차결합을 통해 PEG 하이드로겔을 합성합니다.
아크릴레이트, 메타아크릴레이트, 알릴 에테르, 말레이마이드, 비닐술폰, NHS 에스테르 및 비닐 에테르기(도표 1)와 같은 반응성 사슬 말단이 있는 PEG 대형 단량체는 바로 사용할 수 있는 출발 물질로부터 쉽게 합성됩니다. PEG의 알코올 사슬 말단은 베이스가 있는 곳에서 염화 아크릴로일, 염화 메타크릴로일 등의 산성 염화물을 사용하여 에스테르화됩니다. PEG 사슬 말단은 기본 조건 하에서 2-클로로에틸 비닐에테르나 브롬화알릴과 같은 할로겐화 알킬과의 반응에 의해 에스테르화됩니다. PEG 디비닐술폰은 PEG를 다량의 디비닐술폰에 결합하거나 염기를 제거하여 비닐술폰기9를 형성하는 과정을 거친 클로로에틸 술폰 사슬 말단을 제조하는 다단계 공정을 통해 형성됩니다.
![End groups of different PEG macromers End groups of different PEG macromers]()
도표 1 Mechanisms of Hydrogel Formation
대형 단량체는 동형 이작용기성(homobifunctional)이거나 이형 이작용기성(heterobifunctional)일 수 있습니다. 동형 이작용기성 대형 단량체는 일반적으로 네트워크를 형성하는 데 사용되는 반면, 이형 이작용기성 대형 단량체는 치료 분자를 하이드로겔 네트워크로 결합하는 데 사용될 수 있습니다.
Mechanisms of Hydrogel Formation
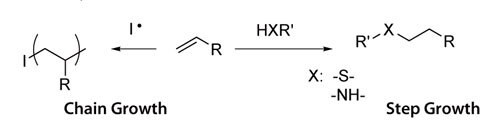
하이드로겔을 형성하기 위한 교차결합 메커니즘은 PEG 대형 단량체 사슬 말단의 정체성에 따라 달라집니다. 대부분의 경우 반응성 비닐 사슬 말단이 중합될 때 교차결합이 발생하는데, 보통 자유 라디칼 개시인자를 사용합니다. 예를 들어 과황산암모늄 및 TEMED와 같은 산화환원 반응 생성 라디칼을 사용하거나 빛으로 생성된 라디칼(예: Irgacure® 651, λ= 365 nm 개요 1)을 사용하여 대형 단량체의 중합반응을 개시할 수 있습니다. 아크릴레이트 및 메타아크릴레이트 사슬 말단은 연쇄중합 반응을 겪게 됩니다. 네트워크 형성의 계단식 성장에서는 복합 (f>2) 가교제가 PEG 사슬 말단과 화학량론적 방식으로 반응합니다. 그 대신에 복합 PEG(f>2)는 2관능성 가교제와 교차결합될 수 있습니다(개요 1). 아크릴레이트, 메타아크릴레이트, 비닐술폰, 말레이마이드, 비닐에테르 및 알릴 에테르는 반응 조건에 따라 티올로 변환하여 모두 계단식 성장 네트워크를 형성할 수 있습니다. 일반적인 가교제에는 티올 또는 아민 모이어티가 포함될 수 있습니다. 동일한 반응 용기에서 두 가지 메커니즘이 발생하면 혼합형 중합반응이 일어나며 아크릴레이트기 및 메타아크릴레이트기는 혼합형 네트워크 형성을 겪을 수 있습니다. 두 가지 하이드로겔 형성 메커니즘은 살아있는 세포를 캡슐화하는 데 사용될 수 있으며, 모두 펩타이드, 단백질 및 기타 치료제의 반응성 통합을 가능하게 합니다.
![Chain growth and step growth reactions Chain growth and step growth reactions]()
개요 1 Chain growth and step growth reactions.
다양한 메커니즘에서 발생하는 그물 모양 구조는 그림 1에 표시되어 있습니다. 사슬 성장 네트워크에서는 운동 사슬이 교차결합 위치에서 형성되는 반면 계단식 성장 네트워크에서는 교차결합 위치가 복합 가교제와 동일한 기능을 가지며 결함을 무시합니다. 사슬 성장과 계단식 성장 모두에서 루프, 영구적인 얽힘 및 매달린 사슬 말단 등의 네크워크 결함이 존재할 수 있습니다. 대형 단량체의 화학적 정체성과 하이드로겔 형성 메커니즘은 하이드로겔 네트워크의 교차결합 밀도에 각각 영향을 미치기 때문에 모두 중요합니다. 2D와 3D 배양에 중요한 재료 특성은 하이드로겔 형성 화학 반응을 통해 쉽게 제어됩니다. 교차결합 밀도가 증가하면 그물 모양의 크기가 작아지고 팽창 비율이 감소하며 저장 계수가 증가합니다. PEG 대형 단량체의 분자량을 변화시키면 교차결합 밀도의 차이가 커지는 등 하이드로겔 특성에 대한 제어가 정확하지 않게 됩니다. 하이드로겔을 생성하는 데 사용되는 반응 메커니즘을 변경하면 하이드로겔 특성에 대한 정밀한 제어가 가능하여 시스템의 교차결합 밀도를 조정하는 데 사용할 수 있습니다.
![하이드로겔 형성 메커니즘은 하이드로겔 네트워크 구조에 영향을 줍니다. 하이드로겔 형성 메커니즘은 하이드로겔 네트워크 구조에 영향을 줍니다.]()
그림 1 하이드로겔 형성 메커니즘은 하이드로겔 네트워크 구조와 네트워크 결함에 영향을 줍니다.
Degradeable Hydrogels
3D 하이드로겔 뼈대를 사용하여 세포 분화와 조직의 진화를 연구하기 위해서는 시공간적 제어 방식으로 겔의 물리적, 화학적 특성을 제어할 수 있어야 합니다.10 고분자 재료 특성은 일반적으로 중합반응/교차결합(결합 형성 반응) 또는 제어된 분해 및/또는 방출(결합 파괴 반응)을 통해 변경됩니다. 결합 형성 반응은 일반적으로 저분자 시약(개시제, 촉매, 단량체, 재료에 사용되는 리간드)을 사용하지만, 결합 파괴는 통상적으로 외인성 시약에 의존하지 않습니다. 종종 저분자는 고분자 시약에 비해 체외 및 체내에서 더 많은 부작용을 일으키기 때문에 많은 연구진은 고분자 바이오 재료의 원위치 조작을 위한 도구로서 분해를 사용합니다.
Hydrolytic Degradation
하이드로겔에서 가장 일반적으로 사용되는 분해 메커니즘은 가수 분해로, 물 분자가 고분자 중추에 첨가되어 연쇄적인 분리를 일으킵니다. 무수물, 에스테르, 아미드는 모두 가수 분해에 취약합니다. 무수물은 통상적으로 너무 빠르게 가수 분해되고 아미드의 촉매화되지 않은 가수 분해는 너무 느리기 때문에, 가수 분해로 분해되는 대부분의 하이드로겔은 에스테르 결합을 이용합니다. 생리학적으로 적절한 시간 비율로 가수 분해할 수 있는 하이드로겔을 얻기 위해 보통 락티드 또는 글리콜라이드 조각을 사용하여 분해 가능한 에스테르 결합으로 PEG를 기능화합니다.
PEG의 알코올 사슬 말단은 3,6-다이메틸-1,4-다이옥산-2,5-디온 및 1,4-다이옥산-2,5-디온의 고리열림반응을 시작하여 각각 PEG-락티드 및 PEG-글리콜라이드를 생성할 수 있습니다(개요 2).11 고리열림반응은 일반적으로 틴(II)-2-헥사논산에틸에 의해 촉매화됩니다.12 이 반응은 다이메틸아미노피리딘을 촉매로 사용하여 쉽게 얻을 수도 있지만13 잔류 주석보다 제거하기 더 쉬울 수 있습니다. PEG-락티드 또는 PEG-글리콜라이드의 알코올 사슬 말단은 아크릴레이트 및 메타아크릴레이트 같은 반응성 이중 결합으로 쉽게 기능화됩니다.
![Synthesis of PEG-lactide and PEG-glycolide Synthesis of PEG-lactide and PEG-glycolide]()
개요 2 Synthesis of PEG-lactide and PEG-glycolide.
Enzymatic Degradation
에스테르 결합은 효소 분해가 가능하지만, 대부분의 연구자는 에스테르와 아미드의 비특이적인 효소 분해보다는 하이드로겔에 통합된 펩타이드의 시퀀스별 효소 분해 기능을 이용합니다. Hubbell은 아크릴레이트, 말레이마이드 및 비닐술폰을 넘어 시스테인 기능성 펩타이드의 마이클 첨가 반응을 통해 MMP(Matrix Metalloproteinase) 민감 연계를 하이드로겔에 통합하는 접근 방식16을 개척했습니다(개요 3).17
또한 MMP 분해성 결합은 치료제를 하이드로겔로 결합하는 데 사용될 수도 있습니다. 예를 들어 혈관 내피 성장 인자(VEG-F)와 같은 성장 인자는 MMP에 민감한 사슬의 효소 분해를 통해 방출되어 혈관 형성을 유도할 수 있습니다.18
분해율은 가수 분해와 효소 분해 모두에서 대형 단량체의 화학 반응에 의해 미리 결정됩니다. 가수 분해에서 재료의 분해율은 가수 분해 가능군의 정체성(예: 소수성 또는 친수성) 및 수량을 통해 미리 설계되며, 일단 재료가 제조되면 변경할 수 없습니다. 효소 분해에서 분해는 일반적으로 효소를 생성하는 세포의 국소 영역에서 발생합니다. 가수 분해와 효소 분해는 모두 하이드로겔의 지속적인 분해 및 치료제의 지속적인 방출에 효과적인 방법이지만, 하이드로겔이 제조된 후에는 방출률을 조정하거나 억제할 수 없으며 방출을 공간적으로 제어할 수 없습니다.
![Enzymatically degradable hydrogels Enzymatically degradable hydrogels]()
개요 3 마이클 첨가 반응을 통한 효소 분해성 하이드로겔은 시스테인 함유 펩타이드를 비닐술폰기에 첨가합니다.
Photodegradable Hydrogels
가수 분해 및 효소 분해가 가능한 결합과는 대조적으로 광분해성 결합은 분해와 방출에 대한 정확한 공간 및 시간적 제어가 가능합니다. 많은 연구자가 광학적 중합이 가능한 광기능성 하이드로겔을 보고했지만, 생체에 적합한 광분해성 하이드로겔에 대한 보고는 거의 존재하지 않습니다. Kloxin과 Kasko는 2-메톡시-5-니트로-4-(1-하이드록시에틸) 페녹시부탄산염을 함유한 PEG 대형 단량체(개요 4)에서 형성된 광분해성 하이드로겔 네트워크를 보고했으며19, 여기에는 오르토-니트로벤질(o-NB) 결합의 광분해 행동이 잘 특성화되어 있습니다. 광분해성 대형 단량체에서 형성된 하이드로겔은 빛에 노출되면 벌크 분해 반응을 보이며, 노출 시간, 파장 및 빛의 강도에 따라 다르게 나타납니다. 빛이 차단되면 분해가 저지되고 빛 노출이 재개되면 시료는 광분해를 지속합니다. 인간의 중간엽줄기세포(human mesenchymal stem cells, hMSC)는 광방출성 세포부착 리간드 RGDS(Arg-Gly-Asp-Ser)를 포함하는 하이드로겔에 캡슐화되어 10일째(연골형성 중 섬유결합소의 하향 조절에 해당)에 RGD가 방출되면 연골 발생 경로를 따라 분화됩니다. 이러한 분해성 하이드로겔의 표면 침식과 스루겔 리소그래피는 10-7 m에서 10-2 m 또는 그 이상의 길이 스케일에 걸쳐 형상을 만드는 데 사용할 수 있습니다.20 국소 영역의 부분 분해로 인해 교차결합 밀도가 저하되고 팽창이 증가하여 겔에서 돌출된 하이드로겔에 부드러운 형상을 에칭하는 수단을 제공합니다.
![Photodegradable o-NB moieties Photodegradable o-NB moieties]()
개요 4 광분해성 o-NB 모이어티는 하이드로겔 중추에 통합되어 치료제 방출을 위해 사용됩니다.
단일 광자 광분해 외에도 하이드로겔을 포함하는 o-NB는 이광자 광분해에도 민감하여 3D 에칭을 허용합니다.19-20 단일 광자 반응에서는 빛에 노출된 모든 영역이 반응하게 됩니다. 이와 반대로 다광자 리소그래피는 광원의 초점 용량(내부)에서 발생하는 여러 개의 광자가 동시에 흡수되는 경우에만 발생합니다. 바이오 소재의 단일 광자 리소그래피에서 일반적인 파장은 장파 UV(365 nm 이상)에서 가시 영역까지인 반면에 이광자 리소그래피는 IR 광선(통상 740-800 nm까지)을 사용합니다. IR 광선은 생체 적합성이 더 높고 살아있는 조직을 거의 파괴하지 않으면서 더 큰 침투 깊이를 제공합니다. 또한 이광자 흡수가 발생할 확률은 광선의 전체 경로가 아닌 집중 광선의 중심점으로 엄격히 제한되어 발생하고, 자극에 대한 3D 제어가 가능합니다. 단일 광자와 다광자 반응 모두 잠재적으로 500 nm보다 작은 형상을 가진 소재를 패턴화할 수 있습니다.21 이는 하이드로겔 뼈대 구조와 화학 반응에 대한 전례 없는 수준의 공간적 제어력을 보여줍니다.
![Single and two photon photolysis Single and two photon photolysis]()
그림 2 단일 광자 광분해(왼쪽)는 UV 가시광선에 노출된 하이드로겔의 전 영역에서 발생하며 이광자 광분해(오른쪽)는 IR 광선 이광자의 동시 흡수가 일어나는 영역에서만 발생합니다.
o-NB 링커는 치료제를 하이드로겔로 결합하여 살아있는 세포로 전달하는 데도 사용될 수 있습니다. Griffin 외는 o-NB-PEG 대형 단량체를 통해 하이드로겔에 결합된 형광물질의 제어된 방출을 입증했습니다.22 이 모델 치료제의 방출은 복합 파장(365-436 nm), 강도(5-20 mW/cm2) 및 지속시간(0-20분)에서 광선 노출의 함수로 정량화되었습니다. 가장 빠른 방출은 365 nm(해당 파장에서 o-NB 결합의 더 높은 몰 흡수 계수에 해당)에서 발생하지만 405 nm에서도 유사한 방출을 보여주며, 이러한 방출은 분자의 몰 흡수 계수와 같은 물리적 상수를 통해 쉽게 모델링됩니다. 광 감쇠는 이러한 시스템에서 화학적, 기계적 구배를 신속하게 형성해 줍니다.
결론
폴리(에틸렌 글리콜)는 손쉽게 사용 및 변형할 수 있는 고분자입니다. 조직 배양을 위한 2D 및 3D 뼈대를 포함하는 하이드로겔 제조에 광범위하게 사용되고 있습니다. PEG 하이드로겔에 분해성 결합을 쉽게 도입할 수 있습니다. 가수 분해학적으로 분해 가능한 겔은 지속적인 물질 분해 및/또는 치료제 방출을 가능하게 합니다. 효소 분해성 겔의 분해와 방출은 세포에 의해 결정됩니다. 광분해를 사용하면 사용자는 하이드로겔의 화학적, 물리적 특성을 외부에서 실시간으로 조작할 수 있습니다.
| | | |
제품 번호 | 이미지 | 설명 | 장바구니에 추가 |
|---|
| 689882 | ![]() | O-(2-Aminoethyl)-O′-[2-(biotinylamino)ethyl]octaethylene glycol ≥95% (oligomer purity) | | | | | 671487 | ![]() | O-(2-Aminoethyl)-O′-(2-carboxyethyl)polyethylene glycol hydrochloride Mp 3,000 | | | | | 671592 | ![]() | O-(2-Aminoethyl)-O′-(2-carboxyethyl)polyethylene glycol 5,000 hydrochloride Mp 5,000 | | | | | 672130 | ![]() | O-(2-Aminoethyl)polyethylene glycol Mp 5,000 | | | | | 671924 | ![]() | O-(2-Aminoethyl)polyethylene glycol Mp 10,000 | | | | | 07969 | ![]() | O-(2-Aminoethyl)polyethylene glycol 3,000 Mp 3,000 | | | | | 672165 | ![]() | O-(2-Aminoethyl)-O′-(2-(succinylamino)ethyl)polyethylene glycol hydrochloride Mp 10,000 | | | | | 689440 | ![]() | O-(2-Azidoethyl)heptaethylene glycol ≥95% (oligomer purity) | | | | | 669946 | ![]() | O-[2-(Biotinyl-amino)ethyl]-O′-(2-carboxyethyl)polyethylene glycol Mp 3,000 | | | | | 689998 | ![]() | O-[2-(Biotinylamino)ethyl]-O′-(2-carboxyethyl)undecaethylene glycol ≥95% (oligomer purity) | | | | | 670049 | ![]() | O-[2-(Biotinyl-amino)ethyl]-O′-[3-(N-succinimidyloxy)-3-oxopropyl]polyethylene glycol Mp 3,000 | | | | | 689653 | ![]() | O-(2-Carboxyethyl)-O′-[2-(Fmoc-amino)-ethyl]heptacosaethylene glycol ≥90% (oligomer purity) | | | | | 670812 | ![]() | O-(2-Carboxyethyl)polyethylene glycol 3,000 | | | | | 671037 | ![]() | O-(2-Carboxyethyl)polyethylene glycol 10,000 | | | | | 712515 | ![]() | O-(3-Carboxypropyl)-O′-[2-(3-mercaptopropionylamino)ethyl]-polyethylene glycol Mw 3000 | | | | | 712523 | ![]() | O-(3-Carboxypropyl)-O′-[2-(3-mercaptopropionylamino)ethyl]-polyethylene glycol Mw 5000 | | | | | 259268 | ![]() | Hexaethylene glycol 97% | | | | | 670162 | ![]() | O-[N-(6-Maleimidohexanoyl)aminoethyl]-O′-(2-carboxyethyl)polyethylene glycol Mp 3,000 | | | | | 670278 | ![]() | O-[N-(6-Maleimidohexanoyl)aminoethyl]-O′-[3-(N-succinimidyloxy)-3-oxopropyl]polyethylene glycol 3,000 Mp 3,000 | | | | | 689777 | ![]() | O-[N-(3-Maleimidopropionyl)aminoethyl]-O′-[3-(N-succinimidyloxy)-3-oxopropyl]heptacosaethylene glycol ≥90% (oligomer purity) | | | | | 719080 | ![]() | PEG-ditosylate average Mn 1,300 | | | | | 705047 | ![]() | PEG-ditosylate average Mn 10,000 | | | | | 701750 | ![]() | PEG-di-p-tosylate average Mn 3,500 | | | | | 335754 | ![]() | Pentaethylene glycol 98% | | | | | 81300 | ![]() | Poly(ethylene glycol) average Mn 20,000 | | | | | 202444 | ![]() | Poly(ethylene glycol) average Mn 3,350, powder | | | | | 81210 | ![]() | Poly(ethylene glycol) average Mw 1,500 | | | | | 295906 | ![]() | Poly(ethylene glycol) average Mn 2,050, chips | | | | | 309028 | ![]() | Poly(ethylene glycol) average Mn 10,000, flakes | | | | | 14509 | ![]() | Poly(ethylene glycol) bis(amine) Mw 20,000 | | | | | 14501 | ![]() | Poly(ethylene glycol) bis(amine) Mw 2,000 | | | | | 14502 | ![]() | Poly(ethylene glycol) bis(amine) Mw 3,000 | | | | | 407038 | ![]() | Poly(ethylene glycol) bis(carboxymethyl) ether average Mn 600 | | | | | 406996 | ![]() | Poly(ethylene glycol) bis(carboxymethyl) ether average Mn 250 | | | | | 699810 | ![]() | Poly(ethylene glycol) diacetylene average Mn 2,000 | | | | | 475629 | ![]() | Poly(ethylene glycol) diacrylate average Mn 250 | | | | | 701963 | ![]() | Poly(ethylene glycol) diacrylate average Mn 6,000, contains ≤1500 ppm MEHQ as inhibitor | | | | | 729094 | ![]() | Poly(ethylene glycol) diacrylate average Mn 10,000, contains MEHQ as inhibitor | | | | | 729086 | ![]() | Poly(ethylene glycol) diacrylate average Mn 1,000, contains MEHQ as inhibitor | | | | | 475696 | ![]() | Poly(ethylene glycol) diglycidyl ether average Mn 500 | | | | | 409510 | ![]() | Poly(ethylene glycol) dimethacrylate average Mn 550, contains 80-120 ppm MEHQ as inhibitor, 270-330 ppm BHT as inhibitor | | | | | 687537 | ![]() | Poly(ethylene glycol) dimethacrylate average Mn 6,000, contains 1000 ppm 4-methoxyphenol as inhibitor | | | | | 725692 | ![]() | Poly(ethylene glycol) dimethacrylate average Mn 20,000, contains MEHQ as inhibitor | | | | | 725684 | ![]() | Poly(ethylene glycol) dimethacrylate average Mn 10,000, contains MEHQ as inhibitor | | | | | 717142 | ![]() | Poly(ethylene glycol) dithiol average Mn 1,000 | | | | | 704539 | ![]() | Poly(ethylene glycol) dithiol average Mn 3,400 | | | | | 705004 | ![]() | Poly(ethylene glycol) dithiol average Mn 8,000 | | | | | 410195 | ![]() | Poly(ethylene glycol) divinyl ether average Mn 250 | | | | | 752398 | ![]() | Poly(ethylene glycol), 4 hydroxyl dendron, generation 1 average Mn 20,300 | | | | | 579319 | ![]() | Poly(ethylene glycol), α-maleimidopropionamide-ω-formyl terminated average Mn 3,000 | | | | | 409537 | ![]() | Poly(ethylene glycol) methacrylate average Mn 360, contains 500-800 ppm MEHQ as inhibitor | | | | | 409529 | ![]() | Poly(ethylene glycol) methacrylate average Mn 500, contains 900 ppm monomethyl ether hydroquinone as inhibitor | | | | | 81323 | ![]() | Poly(ethylene glycol) methyl ether average Mn 5,000 | | | | | 202487 | ![]() | Poly(ethylene glycol) methyl ether average Mn 550 | | | | | 202495 | ![]() | Poly(ethylene glycol) methyl ether average Mn 750 | | | | | 732621 | ![]() | Poly(ethylene glycol) methyl ether average Mn 10,000 | | | | | 732613 | ![]() | Poly(ethylene glycol) methyl ether average Mn 20,000 | | | | | 699802 | ![]() | Poly(ethylene glycol)methyl ether acetylene average Mn 2,000 | | | | | 730289 | ![]() | Poly(ethylene glycol) methyl ether acrylate average Mn 5,000, contains MEHQ as inhibitor | | | | | 730270 | ![]() | Poly(ethylene glycol) methyl ether acrylate average Mn 2,000, contains MEHQ as inhibitor | | | | | 740705 | ![]() | Poly(ethylene glycol) methyl ether 2-(dodecylthiocarbonothioylthio)-2-methylpropionate average Mn 1,100 | | | | | 731765 | ![]() | Poly(ethylene glycol) methyl ether maleimide average Mn 2,000 | | | | | 447951 | ![]() | Poly(ethylene glycol) methyl ether methacrylate average Mn 950, contains 300 ppm BHT as inhibitor, 100 ppm MEHQ as inhibitor | | | | | 730327 | ![]() | Poly(ethylene glycol) methyl ether methacrylate average Mn 4,000, contains ≤300 ppm monomethyl ether hydroquinone as inhibitor | | | | | 730319 | ![]() | Poly(ethylene glycol) methyl ether methacrylate average Mn 1500, contains ≤300 ppm monomethyl ether hydroquinone as stabilizer | | | | | 729108 | ![]() | Poly(ethylene glycol) methyl ether thiol average Mn 800 | | | | | 729140 | ![]() | Poly(ethylene glycol) methyl ether thiol average Mn 2,000 | | | | | 729159 | ![]() | Poly(ethylene glycol) methyl ether thiol average Mn 6,000 | | | | | 729116 | ![]() | Poly(ethylene glycol) methyl ether tosylate average Mn 900 | | | | | 729124 | ![]() | Poly(ethylene glycol) methyl ether tosylate average Mn 2,000 | | | | | 729132 | ![]() | Poly(ethylene glycol) methyl ether tosylate average Mn 5,000 | | | | | 309524 | ![]() | Poly(ethylene glycol) tetrahydrofurfuryl ether average Mn 200 | | | | | 181986 | ![]() | Poly(ethylene oxide) average Mv 100,000, powder | | | | | 182028 | ![]() | Poly(ethylene oxide) average Mv 600,000, powder | | | | | 181994 | ![]() | Poly(ethylene oxide) average Mv 200,000, powder | | | | | 110175 | ![]() | Tetraethylene glycol 99% | | | | | 712507 | ![]() | O-[2-(3-Tritylthiopropionylamino)ethyl]polyethylene glycol Mp 3,000 | | | |
|
|
참고문헌
- (a) Drury, J. L.; Mooney, D. J. Biomaterials 2003, 24, 4337-4351.
(b) Lee, K. Y.; Mooney, D. J. Chem. Rev. 2001, 101, 1869-1879.
(c) Hoffman, A. S. Bioartificial Organs III: Tissue Sourcing, Immunoisolation, and Clinical Trials;Hunkeler, D., Ed.; New York Academy of Sciences: New York, 2001; pp 62-73.
(d) Hoffman, A. S. Adv. Drug Delivery Rev. 2002, 54, 3-12.
- (a) Tibbitt, M. W.; Anseth, K. S. Biotechnol. Bioeng. 2009, 103, 655-663.
(b) Lin, C. C.; Anseth, K. S. Pharm. Res. 2009, 26, 631-643.
- (a) Richter, A.; Paschew, G.; Klatt, S.; Lienig, J.; Arndt, K. F.; Adler, H. J. P. Sensors 2008, 8, 561-581.
(b) Gupta, P.; Vermani, K.; Garg, S. Drug Discovery Today 2002, 7, 569-579.
- Ruel-Gariepy, E.; Leroux, J. C. Eur. J. Pharm. Biopharm. 2004, 58, 409-426.
- Yang, Z.; Xu, B. J. Mater. Chem. 2007, 17, 2385-2393.
- Zalipsky, S.; Harris, J. M. Poly(Ethylene Glycol) 1997, 680, 1-13.
- Davis, F. F. Adv. Drug Deliver Rev. 2002, 54, 457-458.
- Merrill, E. W.; Salzman, E. W.; Wan, S.; Mahmud, N.; Kushner, L.; Lindon, J. N.; Curme, J. T. Am. Soc. Art. Int. Org. 1982, 28, 482-487.
- Morpurgo, M.; Veronese, F. M.; Kachensky, D.; Harris, J. M. Bioconjugate Chem. 1996, 7, 363-368.
- Lutolf, M. P.; Hubbell, J. A. Nat. Biotechnol. 2005, 23, 47-55.
- Sawhney, A. S.; Pathak, C. P.; Hubbell, J. A. Macromolecules 1993, 26, 581-587.
- Du, Y. J.; Lemstra, P. J.; Nijenhuis, A. J.; Vanaert, H. A. M.; Bastiaansen, C. Macromolecules 1995, 28, 2124-2132.
- Nederberg, F.; Connor, E. F.; Moller, M.; Glauser, T.; Hedrick, J. L. Angew. Chem. Int. Edit. 2001, 40, 2712-2715.
- Kim, H.; Kim, H. W.; Suh, H. Biomaterials 2003, 24, 4671-4679.
- Benoit, D. S. W.; Nuttelman, C. R.; Collins, S. D.; Anseth, K. S. Biomaterials 2006, 27, 6102-6110.
- West, J. L.; Hubbell, J. A. Macromolecules 1999, 32, 241-244.
- (a) Lutolf, M. P.; Hubbell, J. A. Biomacromolecules 2003, 4, 713-722.
(b) Lutolf, M. P.; Lauer-Fields, J. L.; Schmoekel, H. G.; Metters, A. T.; Weber, F. E.; Fields, G. B.; Hubbell, J. A. P. Natl. Acad. Sci. USA 2003, 100, 5413-5418.
- Zisch, A. H.; Lutolf, M. P.; Ehrbar, M.; Raeber, G. P.; Rizzi, S. C.; Davies, N.; Schmokel, H.; Bezuidenhout, D.; Djonov, V.; Zilla, P.; Hubbell, J. A. Faseb. J. 2003, 17, 2260.
- (a) Kloxin, A. M.; Kasko, A. M.; Salinas, C. N.; Anseth, K. S. Science 2009, 324, 59-63.
(b) Kloxin, A. M.; Tibbitt, M. W.; Kasko, A. M.; Fairbairn, J. A.; Anseth, K. S. Adv. Mater. 2010, 22, 61-66.
- Wong, D. Y.; Griffin, D. R.; Reed, J.; Kasko, A. M. Macromolecules 2010, 43, 2824-2831.
- Kasko, A. M.; Wong, D. Y. Future Med. Chem. 2010, 2, 1669-1680.
- Griffin, D. R.; Patterson, J. T.; Kasko, A. M. Biotechnol. Bioeng. 2010, 107, 1012-1019.