Dosage de l'activité enzymatique
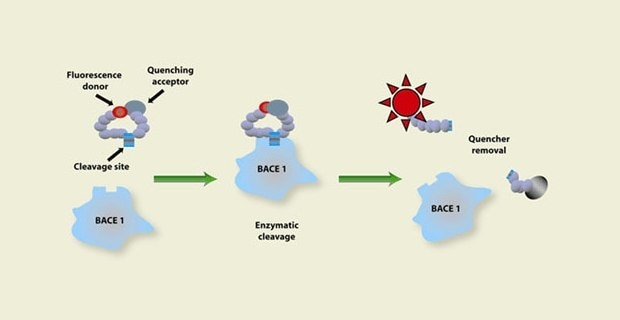
Figure 1.Représentation du fonctionnement d'un dosage d'activité enzymatique commençant avec un donneur doué de fluorescence et un accepteur capable d'extinction sur un substrat qui subit un clivage enzymatique pour éliminer l'extincteur, montrant une augmentation de l'activité fluorescente qui signale l'existence d'une activité enzymatique.
Les tests de dosage de l'activité enzymatique sont principalement réalisés par les chercheurs pour détecter la présence d'une enzyme donnée ou la quantifier dans un organisme, un tissu ou un échantillon. Voici quelques exemples de ces enzymes : l'α-amylase, la catalase, la laccase, la peroxydase, le lysozyme et les enzymes rapporteuses phosphatase alcaline et luciférase. Il existe une multitude de réactifs et de techniques qui permettent d'étudier les interactions entre des enzymes et des substrats donnés. Le choix d'une solution de dosage adaptée dépendra de la sensibilité attendue par le chercheur. Si les solutions colorimétriques sont utiles pour la détection, les réactifs fluorescents sont mieux adaptés à la quantification de l'activité enzymatique.
Catégories à la une
Retrouvez des protocoles et des ressources pour la dissociation des tissus et le détachement des cellules, ainsi qu'une offre complète d'enzymes fiables et très bien caractérisées, notamment la trypsine, la collagénase, la papaïne, les nucléases (DNase et RNase), l'hyaluronidase, l'élastase et la protéase XIV.
Les substrats et les enzymes sont essentiels dans la recherche en sciences de la vie, à la fois comme outils et comme cibles dans les systèmes de détection. Explorez notre catalogue d'enzymes et de substrats de détection et découvrez des systèmes de détection de protéines à base d'enzymes pour les tests ELISA, l'immunohistochimie, le western blotting et bien d'autres techniques.
Enzymes pour l'analyse de drogues et de médicaments comprenant la bêta-glucuronidase (β-glucuronidase) et la sulfatase pour les études du métabolisme des médicaments et les analyses de dépistage de drogues.
Nos différentes coenzymes se caractérisent par leur haute qualité et leur fiabilité. Elles facilitent le travail des enzymes et catalysent des réactions pour vos applications de recherche.
Détermination des conditions optimales à l'activité enzymatique
Si de nombreux dosages enzymatiques sont décrits dans la littérature, il est nécessaire de modifier ces procédures pour s'adapter aux particularités de l'enzyme étudiée. L'activité propre à une enzyme dépend de nombreux facteurs, notamment le pH, la température, la force ionique et la concentration de tous les constituants du test. Pour des conditions comme le pH, l'activité enzymatique suit souvent à une courbe en cloche. L'activité maximale à un pH donné est notée Vmax et on observe une décroissance de l'activité aux deux extrémités de la courbe. Certaines enzymes peuvent nécessiter la prise en compte d'autres facteurs pour des composants non directement impliqués dans la réaction, comme les ions métalliques, les détergents et les molécules hydrophobes.
Détermination des conditions optimales à l'activité enzymatique
Si de nombreux dosages enzymatiques sont décrits dans la littérature, il est nécessaire de modifier ces procédures pour s'adapter aux particularités de l'enzyme étudiée. L'activité propre à une enzyme dépend de nombreux facteurs, notamment le pH, la température, la force ionique et la concentration de tous les constituants du test. Pour des conditions comme le pH, l'activité enzymatique suit souvent à une courbe en cloche. L'activité maximale à un pH donné est notée Vmax et on observe une décroissance de l'activité aux deux extrémités de la courbe. Certaines enzymes peuvent nécessiter des considérations supplémentaires pour les composants qui ne sont pas directement impliqués dans la réaction, tels que les ions métalliques, les détergents et les molécules hydrophobes.
Composants du dosage enzymatique
Pour de nombreuses enzymes, le solvant standard est l'eau, car elle crée le même environnement aqueux que celui que l'on retrouve dans les cellules. Il arrive cependant que des solvants organiques soient utilisés lorsque les enzymes ou les constituants enzymatiques ne sont pas solubles dans l'eau. Les substrats et les cofacteurs (catalyseurs de réactions enzymatiques) sont également des constituants clés d'un test enzymatique. Ces substrats et cofacteurs sont souvent identifiés d'après leurs fonctions dans des conditions physiologiques. Par conséquent, les substrats et les cofacteurs interagissent largement et de multiples enzymes peuvent en avoir besoin. Les tampons et les ions sont d'autres éléments clés à prendre en compte, car ils sont essentiels pour stabiliser le pH tout au long du dosage et influencent directement l'activité enzymatique. Par exemple, des ions métalliques monovalents et divalents peuvent être nécessaires à l'activité catalytique des cofacteurs de la réaction et sont essentiels à l'activité enzymatique.
Réalisation d'un dosage enzymatique
La préparation des constituants du test enzymatique est une première étape concrète. Il est généralement utile de préparer une grande quantité de mélange de dosage, en excluant un constituant activateur, pour éviter les erreurs de pipetage inhérentes au pipetage de petits volumes. Une fois le mélange préparé, les chercheurs ajouteront le constituant activateur final au mélange pour initier le dosage de l'activité enzymatique. Le prétraitement de l'enzyme par conservation à basse température et souvent l'ajout de divers additifs chimiques ou protéiques sont des facteurs déterminants pour garantir la stabilité de l'enzyme et une activité maximale avant le début du dosage. Une fois les différents constituants du mélange réactionnel réunis dans un récipient d'observation, ils doivent être rapidement et soigneusement mélangés pendant que la réaction commence. L'enregistrement des données doit débuter juste après le mélange et le tracé de la courbe du signal détectable doit correspondre à l'intégralité de la durée de la réaction.
Consultez notre recherche de documents pour trouver des fiches de données de sécurité, des certificats et de la documentation technique.
Articles techniques apparentés
- Explore compound library screening options with our Pharmacologically Active Compounds portfolio.
- Cholesterol esterification enhances transport efficiency in lipoproteins for increased blood stream transport.
- Complete List of Enzyme Commission Numbers for metabolics research.
- Cathepsin B is a lysosomal cysteine proteinase with broad specificity. This protocol uses Nα–CBZ–Arg–Arg–7–amido–4–methylcoumarin as the substrate for fluorometric detection of Cathepsin B activity.
- Firefly luciferase is a sensitive reporter for gene studies due to its absence in mammalian cells or tissues.
- Afficher tout (31)
Protocoles apparentés
- Cathepsin B is a lysosomal cysteine proteinase with broad specificity. This protocol uses Nα–CBZ–Arg–Arg–7–amido–4–methylcoumarin as the substrate for fluorometric detection of Cathepsin B activity.
- This page provides information about different pull-down assays for the further isolation of multiprotein complexes to identify their components with products from Cytiva.
- Follow our procedure for the determination of alpha-Amylase activity. This enzymatic assay of a-Amylase guides you through the entire process and necessary calculations.
- This procedure may be used for all Catalase products.
- To measure hyaluronidase activity, a turbidimetric determination assay is used at 600 nm. One unit of hyaluronidase activity will cause a change in absorbance of 0.330 per minute at pH 5.35 at 37 °C.
- Afficher tout (77)
Trouver d'autres articles et protocoles
Comment pouvons-nous vous aider ?
Pour toute question, veuillez formuler une demande d'assistance
ou vous adresser à notre Service Clients :
par e-mail à l'adresse [email protected]
ou en appelant le +1 (800) 244-1173
Autre support
- Chromatogram Search
Use the Chromatogram Search to identify unknown compounds in your sample.
- Calculateurs et Applis
Boîte à outils disponible sur Internet - Outils et ressources pour la recherche scientifique en chimie analytique, sciences de la vie, synthèse chimique et science des matériaux.
- Customer Support Request
Support client, y compris l'aide pour les commandes, les produits, les comptes et les problèmes techniques du site Web.
- FAQ
Explore our Frequently Asked Questions for answers to commonly asked questions about our products and services.
Pour continuer à lire, veuillez vous connecter à votre compte ou en créer un.
Vous n'avez pas de compte ?



