Herstellung und Verwendung von Percoll-Gradienten
Herstellung und Verdünnung einer Percoll-Stammlösung
Um Percoll zur Herstellung eines Gradienten zu verwenden, muss die Osmolalität von Percoll (unverdünnt) zunächst mit Kochsalzlösung oder Zellkulturmedium eingestellt werden, damit Percoll mit physiologischen Salzlösungen isotonisch wird. Die Zugabe von 9 Teilen (v/v) Percoll zu 1 Teil (v/v) 1,5 M NaCl oder 10X konzentriertem Zellkulturmedium ist eine einfache Methode zur Herstellung einer isotonischen Percoll (SIP)-Stammlösung. Die endgültige Einstellung auf die gewünschte Osmolalität kann durch Zugabe von Salzen oder destilliertem Wasser erfolgen. Da die Zelldichte von der Osmolalität abhängt (Abbildung 6), soll die Osmolalität der Stammlösung routinemäßig mit einem Osmometer überprüft werden, um die Reproduzierbarkeit zwischen den Versuchen sicherzustellen. Für subzelluläre Partikel, die in Gegenwart von Salzen aggregieren, kann die isotonische Percoll-Stammlösung (SIP) durch Zugabe von 9 Teilen (v/v) Percoll zu 1 Teil (v/v) 2,5 M Saccharose hergestellt werden.
Die Dichte der SIP-Lösung kann anhand der folgenden Formel berechnet werden:

Wobei:
Vx = Volumen des Verdünnungsmediums (ml) Vo = Volumen des unverdünnten Percoll (ml) ρo = Dichte von Percoll (1,130 + 0,005 g/ml*) ρ10 = Dichte von 1,5 M NaCl = 1,058 g/ml (geringfügige Unterschiede bei anderen Salzen)
Dichte von 2,5 M Saccharose = 1,316 g/ml (geringfügige Unterschiede bei anderen Zusatzstoffen) ρi = Dichte der hergestellten SIP-Lösung (g/ml)
Für SIP in Kochsalzlösung ist ri = 1,123 g/ml und für SIP in Saccharose ist ri = 1,149 g/ml, wobei ro = 1,130 g/ml angenommen wird.
*Genaue Dichte wie auf dem Analysenzertifikat angegeben.
Verdünnen von Percoll-Stammlösungen in niedrigere Dichten
Isotonische Percoll-Stammlösungen (SIP) werden einfach durch Zugabe von 0,15 M NaCl (oder normalstarkem Zellkulturmedium) auf niedrigere Dichten verdünnt, wenn mit Zellen gearbeitet wird, oder mit 0,25 M Saccharose, wenn mit subzellulären Partikeln oder Viren gearbeitet wird.
Mit der folgenden Formel können die Volumina berechnet werden, die erforderlich sind, um eine Lösung mit der gewünschten Dichte zu erhalten.

Wobei:
Vy = Volumen des Verdünnungsmediums in ml
Vi = Volumen des SIP in ml
ρi = Dichte der SIP in g/ml
ρy = Dichte des Verdünnungsmediums in g/ml
(Dichte von 0,15 M NaCl ist ~1,0046 g/ml) *
(Dichte von 0,25 M Saccharose ist ~1,032 g/ml)*
ρ = Dichte der hergestellten verdünnten Lösung in g/ml
Beispiel: Um 55 ml SIP auf eine Enddichte von 1,07 g/ml zu verdünnen, die erforderliche Menge von 0,15 M NaCl bestimmen.

Die vorgenannte Formel ist nützlich, um Dichten zu erreichen, die sehr nahe an der tatsächlich gewünschten Dichte liegen. Geringfügige Schwankungen der Volumina und Dichten der Verdünnungsmedien wirken sich jedoch auf die endgültige Dichte aus. Zur Bestimmung der tatsächlichen Dichten empfehlen wir, die Enddichte von Percoll-Lösungen mit einem Densitometer oder Refraktometer zu messen.
Hinweis: Das Diagramm in Abbildung 5 kann auch als empirischer Leitfaden für die Dichte von Lösungen verwendet werden, die durch Verdünnung von SIP mit 0,15 M Kochsalzlösung oder 0,25 M Saccharose hergestellt werden. Dieses Diagramm bezieht sich auf die Verdünnung von SIP, wobei SIP 90 % (v/v) unverdünntes Percoll ist, das durch Zugabe von 10 % (v/v) Kochsalzlösung oder Saccharose osmotisch eingestellt wird. Um Verwechslungen zu vermeiden, ist es daher vorzuziehen, sich auf die tatsächliche Dichte der Gebrauchslösung zu beziehen (oder % SIP anzugeben), anstatt die Lösung als Prozentsatz von Percoll in isoosmotischer Kochsalzlösung oder Saccharose zu bezeichnen. Dies ist besonders wichtig, wenn das nachstehend beschriebene einstufige Verdünnungsverfahren verwendet wird, bei dem eine Gebrauchslösung mit bekannter Dichte durch Verdünnen von Percoll (unverdünnt) plus konzentrierten Salzen oder Saccharose mit destilliertem Wasser auf ein Endvolumen erhalten wird.

Abbildung 5.Verdünnung der isotonischen Percoll-Stammlösung (SIP) mit isoosmotischer Kochsalz- oder Saccharoselösung. Po ist die Dichte des Percolls (unverdünnt). SIP wird wie beschrieben vorbereitet. Die dargestellten Kalibrierkurven dienen lediglich als Orientierung. Für genaue Dichtemessungen die im Text angegebene Formel verwenden.
Das einstufige Verfahren für die Verdünnung von Percoll
Percoll (unverdünnt) kann anhand des nachstehend beschriebenen Verfahrens direkt verdünnt werden, um eine finale Gebrauchslösung mit bekannter Dichte herzustellen. In einem Messzylinder 1,5 M NaCl oder 2,5 M Saccharose zu 1/10 des gewünschten Endvolumens zugeben (z. B. 10 ml für 100 ml Gebrauchslösung). Die erforderliche Menge Percoll (unverdünnt) hinzugeben, die nach der folgenden Formel berechnet wird. Mit destilliertem Wasser auf das Endvolumen auffüllen.

Wobei:
Vo = Volumen von Percoll (unverdünnt) (ml)
V = Volumen der finalen Gebrauchslösung (ml)
ρ = gewünschte Dichte der Endlösung (g/ml) ρo = Dichte von Percoll (unverdünnt) (g/ml)
(Analysenzertifikat für die genaue Dichte)
ρ10 = Dichte von 1,5 M NaCl = 1,058 (g/ml) (geringfügige Unterschiede bei anderen Salzen)
Dichte von 2,5 M Saccharose = 1,316 (g/ml) (geringfügige Unterschiede bei anderen Zusätzen)
Beispiel: 100 ml einer Percoll-Gebrauchslösung mit einer Dichte von 1,07 g/ml in 0,15 M NaCl herstellen. Zu 10 ml 1,5 M NaCl werden hinzugefügt

Die vorgenannte Formel ist von Nutzen, um Dichten zu erreichen, die in der Nähe der tatsächlich gewünschten Dichte liegen. Geringfügige Schwankungen der Volumina und Dichten der Verdünnungsmedien wirken sich jedoch auf die endgültige Dichte aus. Zur Bestimmung hochgenauer Dichten empfehlen wir die Messung der Enddichte von Percoll-Lösungen mit einem Densitometer oder Refraktometer.
Um das Volumen von Percoll (unverdünnt) mit der Enddichte in Beziehung zu setzen, können Diagramme ähnlich dem in Abbildung 5 erstellt werden.
Verdünnen von Percoll auf eine gewünschte Osmolalität
Um isotonisches Percoll für die meisten Säugerzellen herzustellen, werden üblicherweise 9 Teile Percoll (unverdünnt) mit 1 Teil 1,5 M NaCl oder 2,5 M Saccharose-Lösung verdünnt. Diese isotonische Percoll-Stammlösung (SIP) wird dann je nach Bedarf mit physiologischen Puffern weiter verdünnt. Dieses Verfahren hat sich zwar bewährt, ist aber sehr vereinfacht und berücksichtigt nicht die Auswirkungen der Anwesenheit fester Kieselgelpartikel (d. h. 100 ml Percoll-Stammlösung enthalten ein bestimmtes Volumen an festem Kieselgel, sodass das gesamte wässrige Volumen weniger als 100 ml beträgt). Aufgrund des vom Kieselgel okkupierten Volumens haben die Elektrolyte in der Stammlösung eine höhere effektive Konzentration als in der physiologischen Salzlösung; die so hergestellte SIP wird hyperosmolal sein. Daher wurde stets empfohlen, die tatsächliche Osmolalität der SIP zu bestimmen.
Vincent und Nadeau (555) haben sich dem Problem sehr elegant genähert und zeigen eine Gleichung auf, mit der die Anzahl der Teile Percoll berechnet werden kann, die zu einem Teil 10× konzentriertem physiologischem Salzpuffer hinzugefügt werden sollen, um einen SIP mit der gewünschten Osmolalität zu erhalten. Die Autoren bestimmten den Anteil des Kieselgels am Gesamtvolumen einer Percoll-Stammlösung und ermittelten so das Verhältnis des Volumens der wässrigen Lösung zu dem der gesamten Percoll-Stammlösung.
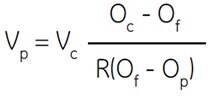
Wobei:
Vp = Anzahl der zuzugebenden Percoll-Anteile
Vc = Anzahl der zuzugebenden Teile des gelösten Konzentrats (z. B. 1,5 M NaCl)
Oc = Osmolalität des gelösten Konzentrats (z. B. 1,5 M NaCl = 2880 mOsm)
Of = gewünschte Osmolalität
R = Verhältnis des wässrigen Volumens zum Gesamtvolumen von Percoll (üblicherweise = 0,85 für NaCl und 0,80 für Saccharose)
Op = Osmolalität von unverdünntem Percoll (Analysenzertifikat)
Die Schlüsselvariable in dieser Gleichung ist R, das ein Maß für das tatsächliche wässrige Volumen einer Percoll-Lösung ist. Der Wert von R ist eine Funktion des hydrodynamischen Volumens, das von den Percoll-Partikeln eingenommen wird. Dieses wiederum ist eine Funktion der Ionenstärke des Mediums, d. h. mit zunehmender Ionenstärke nimmt das hydrodynamische Volumen ab. Es gibt also einen Unterschied im R-Wert von 1,5 M NaCl und 2,5 M Saccharose.
Um einen SIP mit einer Osmolalität = 320 mOsm/kg H2O zu erhalten, der mit 1,5 M NaCl (d. h. 10× konzentrierter physiologischer Kochsalzlösung) eingestellt wurde:

Unter der Annahme:
2880 = Osmolalität von 1,5 M NaCl
(10× konzentrierte physiologische Kochsalzlösung)
20 = Osmolalität von Percoll unverdünnt
Um einen SIP von 320 mOsm/kg H2O zu erhalten, würden also 10 Teile Percoll zu 1 Teil 1,5 M NaCl hinzugefügt.
Auswirkungen der Osmolalität auf die scheinbare Schwebedichte von Zellen und subzellulären Partikeln
Die sehr niedrige Osmolalität von Percoll hat die Untersuchung des Zusammenhangs zwischen der Osmolalität des Trennmediums und der scheinbaren Schwebedichte der Partikel erleichtert. In Abbildung 6 werden die Auswirkungen der Bänderung von Rattenleberhepatozyten in Percoll-Gradienten mit Osmolalitäten von 200, 300 und 400 mOsm/kg H2O dargestellt. Die scheinbare Schwebedichte der Zellen nimmt mit zunehmender Osmolalität zu, was auf den Entzug von Wasser aus den Zellen zurückzuführen ist. Der gleiche Effekt wurde bei Mitochondrien (Abbildung 7) und Lysosomen (Tabelle 1) beobachtet. Schon kleine Veränderungen in der Osmolalität bewirken eine große Änderung der scheinbaren Schwebedichten dieser Organellen. Die tatsächlich gemessenen Schwebedichten von Partikeln, die in Percoll-Gradienten bei physiologischer Osmolalität gebändert sind, entsprechen daher viel eher denen in vivo, als wenn die Partikel in Saccharose oder anderen Zentrifugationsmedien gebändert werden.

Abbildung 6.Fraktionierung von Rattenleber-Hepatozyten-Zellen (35 × 106 Zellen in einem Volumen von 2 ml) auf einem selbst erzeugten Percoll-Gradienten (8 ml Lösung mit einer Dichte von 1,065 g/ml). Die Osmolalität der Percoll-Lösung wurde durch Zugabe von NaCl zu 200 mOsm, 300 mOsm und 400 mOsm eingestellt. Die Zentrifugation erfolgte in einem Beckman-Rotor 30.2 über 15 Minuten bei 35 000 × g bei einer Temperatur von 4 °C. Der Dichtegradient wurde mit Hilfe von Dichtemarker-Beads (Seite 23) bestimmt (27, Wiedergabe mit freundlicher Genehmigung der Autoren und des Herausgebers).

Abbildung 7.Dichteverteilung von Mitochondrien aus Rattenleberzellen nach Inkubation in isoosmotischem Puffer (rot) und Puffer mit 17,5 % Albumin (grün). Die Zentrifugationen wurden in einem Beckman 65-Rotor (23°-Winkel) für 30 Minuten bei 40 000 × g durchgeführt (59, Wiedergabe mit freundlicher Genehmigung der Autoren und des Herausgebers).
Eine lysosomale Fraktion aus Rattenhepatozyten wurde aus einem Percoll/0,25 M Saccharose-Gradienten mit einer Dichte von 1,0 bis 1,05 g/ml gewonnen und in den in der Tabelle beschriebenen Medien 1 h bei 37 °C inkubiert. Die Schwebedichte wurde dann in einem Gradienten aus Percoll/0,25 M Saccharose neu bestimmt (27, Wiedergabe mit freundlicher Genehmigung der Autoren und des Herausgebers).
Faktoren, welche die Bildung und Form von Gradienten beeinflussen
Obwohl das hydrierte Volumen der Percoll-Partikel in Gegenwart von 0,15 M NaCl geringer ist als in Percoll/0,25 M Saccharose ist die Sedimentationsrate der Partikel aufgrund der geringeren Viskosität von Percoll in Kochsalzlösung höher. Wenn also Percoll mit einer Endkonzentration von 0,15 M Kochsalzlösung oder einem Gewebekulturmedium gleicher Ionenstärke isoosmotisch gemacht wird, bildet es einen selbst erzeugten Gradienten etwa 2 bis 3 Mal schneller als die entsprechende Percoll-Lösung, die mit einer Endkonzentration von 0,25 M Saccharose isoosmotisch gemacht wurde.
Zentrifugation und Zeit sind insofern miteinander verknüpft, als die Summe (g-Kraft) × (Zeit) die Form des Gradienten bestimmt. Für Percoll in 0,15 M Kochsalzlösung soll ein Minimum von etwa 10 000 × g und für Percoll in 0,25 M Saccharose etwa 25 000 × g verwendet werden, um in den Winkelkopfrotoren selbst Gradienten zu erzeugen. Die Rotorgeometrie hat unter den gegebenen Bedingungen einen deutlichen Einfluss auf die Gradientenform, wie in Abbildung 8 deutlich wird. Je mehr sich der Winkel der Vertikalen nähert, desto kürzer wird die Weglänge zur Bildung des Gradienten und desto schneller bildet sich der Gradient. In den Abbildungen 9 und 10 wird aufgezeigt, dass auch die Anfangskonzentration von Percoll einen gewissen Einfluss auf die Form des gebildeten Gradienten hat.

Abbildung 8.Der Einfluss des Rotorwinkels auf die Gradientenentwicklung mit Percoll. Die Ausgangsdichte betrug 1,065 g/ml in 0,15 M NaCl. Laufbedingungen: 30 000 × g für 14 min. Die farbigen Linien beziehen sich auf die Positionen der farbigen Dichtemarker-Beads (45, Wiedergabe mit freundlicher Genehmigung der Autoren und des Herausgebers).
Bei der Zentrifugation in Vertikalrotoren bilden sich Percoll-Gradienten sehr schnell. Es muss jedoch darauf geachtet werden, dass das verdichtete Percoll-Pellet, welches sich unter Hochgeschwindigkeitszentrifugationsbedingungen bilden kann, den Gradienten während der Fraktionierung nicht kontaminiert.
Die Verwendung von Ausschwingrotoren zur Eigenerzeugung von Gradienten wird wegen der großen Weglänge und der ungleichen g-Kräfte entlang des Röhrchens nicht empfohlen. Allerdings berichten Jenkins et al. (persönliche Kommunikation und Ref. 87) über einige Vorteile bei der Verwendung dieser Rotortypen in der subzellulären Fraktionierung von Leberorganellen.
Zonalrotoren können zur Bildung von Percoll-Gradienten in situ verwendet werden. Die in Zonalrotoren gebildeten Gradienten haben die gleichen Eigenschaften wie Gradienten, die in Winkelkopfrotoren erzeugt wurden. Aufgrund der großen Probenvolumina wird empfohlen, die Trennbedingungen empirisch in einem nicht zonalen Rotor vor der Aufskalierung in einem Zonalrotor zu bestimmen. Zonalrotoren werden für die Aufreinigung von Viren in großem Maßstab (21) und für die Subfraktionierung von Lysosomen (24) eingesetzt.
Zu Beginn der Arbeit mit selbst erzeugten Gradienten ist es ratsam, einen Modellversuch mit farbigen Dichtemarker-Beads (Seite 22) durchzuführen, um eine Reihe von Standardkurven unter bekannten Bedingungen zu erstellen, die für den Winkelkopfrotor charakteristisch sind, welcher für die nachfolgenden Versuche eingesetzt werden soll.

Abbildung 9.Verwendung farbiger Dichtemarker-Beads zur Darstellung der Gradientenform. Gradienten aus Percoll-Lösungen, die von 90 % bis 20 % der isotonischen Percoll-Stammlösung in 0,15 M NaCl reichen. Laufbedingungen 23° Winkelkopfrotor 30 000 × g, 15 min.

Abbildung 10.Verwendung farbiger Dichtemarker-Beads zur Darstellung der Gradientenformen. Percoll-Verdünnungen wie in Abbildung 9, Laufbedingungen: 23° Winkelkopfrotor, 60 000 × g, 15 min. Durch die höhere g-Kraft wurden steilere Gradienten gebildet.
Diskontinuierliche (stufenförmige) Gradienten
Diskontinuierliche Gradienten bieten eine hohe Flexibilität und Anwenderfreundlichkeit. Oft genügt ein Percoll-Kissen oder ein einziger Schritt bzw. eine einzelne Stufe, um eine hervorragende Anreicherung oder Auflösung eines Zielzelltyps zu erreichen. So können beispielsweise die meisten Blutzellen mit diskontinuierlichen Gradienten angereichert werden (Abbildung 11).

Abbildung 11.Trennung von Lymphozyten und Monozyten durch diskontinuierliche Dichtezentrifugation in Percoll. 1.5 bis 2,0 × 107 PBMC (mononukleäre Zellen des peripheren Bluts), die auf Ficoll-Paque™ isoliert wurden, wurden in 11,25 ml Percoll in Hanks BSS mit 1 % HEPES-Puffer (Dichte = 1,080 g/ml) gemischt und unter die in der Abbildung (69, Wiedergabe mit freundlicher Genehmigung der Autoren und des Herausgebers) gezeigten Sektionen gelegt.
Um einen diskontinuierlichen Gradienten zu bilden, wird die SIP wie auf Seite 12 beschrieben auf eine Reihe unterschiedlicher Dichten verdünnt. Die Lösungen unterschiedlicher Dichte werden dann vorsichtig in der Reihenfolge ihrer Dichte übereinander geschichtet, beginnend mit der dichtesten Lösung am Boden des Röhrchens. Dies geschieht am einfachsten mit einer Pipette oder einer Spritze mit einem großen Kanülendurchmesser. Es ist wichtig, dass die Spitze des Geräts an die Wand des Röhrchens knapp über der Oberfläche der Flüssigkeit gehalten wird, um ein "Spritzen" und eine Vermischung an der Grenzfläche zu vermeiden. Die Bildung eines scharfen Zellbandes an einer Grenzfläche tritt nur auf, wenn sich die Dichte stark ändert.
Die Zentrifugation erfolgt unter relativ schonenden Bedingungen, wie z. B. bei 400 × g für 15 bis 20 Minuten in einer Tischzentrifuge. Diese schonenden Bedingungen führen zu einer isopyknischen Bänderung von Zellen an den entsprechenden Grenzflächen. Die niedrigen g-Bedingungen und die kurze Laufzeit führen nicht zur Sedimentation des Percolls und beeinträchtigen den Gradienten in keiner Weise.
Kontinuierliche lineare und nichtlineare Gradienten
Kontinuierliche Gradienten sind durch eine gleichmäßige Änderung der Dichte von der Oberfläche bis zum Boden des Röhrchens gekennzeichnet. Anstelle der offensichtlichen Grenzflächen, die bei einem diskontinuierlichen Gradienten vorhanden sind, kann man sich einen kontinuierlichen Gradienten mit einer unendlichen Gradientenanzahl vorstellen. Die isopyknische Bänderung der Zellen erfolgt also an der genauen Zelldichte.
Um einen solchen Gradienten zu bilden, wird die SIP zunächst verdünnt, um zwei Lösungen mit bekannter Dichte an den Grenzen des gewünschten Bereichs herzustellen, und dann mit einer Zweikammer-Gradienten-Gießapparatur gemischt. Es bildet sich ein linearer Gradient, der den Bereich zwischen den Grenzwerten der beiden Ausgangslösungen umfasst.
Mit einer Einkanal-Schlauchpumpe in Kombination mit einem Gradientenmischer können abhängig von den relativen Durchmessern der verwendeten Schläuche lineare, konvexe und konkave Gradienten erzeugt werden. Es kann ein sehr enger Dichtebereich im Gradientenverlauf von oben nach unten gebildet werden, um eine maximale Auflösung der viablen Zellen zu erreichen. Schwerere Zellen pelletieren in der Regel, während sich nicht viable Zellen im oberen Bereich des Gradienten befinden. Zum Beispiel pelletieren Erythrozyten, wenn die Dichte im unteren Bereich des Gradienten nicht mehr als 1,08 g/ml beträgt. Dichtemarker-Beads können als externe Marker in einem Röhrchen eingesetzt werden, das einen identischen Gradienten wie das Probenröhrchen enthält.
Die für eine Trennung erforderlichen Zentrifugationsbedingungen sind die gleichen wie bei den diskontinuierlichen Gradienten. Beispiele für Trennungen auf kontinuierlichen Gradienten sind die Aufreinigung von Leydig-Zellen, Laktotropen, Knochenmarkszellen, Darmepithelzellen, marinen Mikroalgen und Chloroplasten.
Vorgeformte, selbst erzeugte Gradienten
Das Vorformen eines Gradienten durch Zentrifugation kann eine komfortable Alternative zur Verwendung einer Gradienten-Gießapparatur oder einer Pumpe darstellen. Wie vorstehend beschrieben, sedimentiert Percoll, wenn es erheblichen g-Kräften (d. h. > 10 000 × g) ausgesetzt wird. Bei der Erstellung eines Gradienten wird die SIP auf eine Dichte verdünnt, die in der Mitte des Bereichs liegt, in dem eine maximale Auflösung erforderlich ist. Zwei Zentrifugenröhrchen werden mit Gradientenmaterial gefüllt (eins für den Versuch und eins mit Dichtemarker-Beads). Dieses zweite Röhrchen dient sowohl als Gegengewicht als auch als externe Methode zur Überwachung des Gradienten. Die Röhrchen werden in einem Winkelkopfrotor zentrifugiert (z. B. 30 000 × g für 15 min), und der Gradient bildet sich isometrisch um die Ausgangsdichte (Abbildung 4). Der relativ "flache" Bereich des Gradienten soll den Bereich abdecken, der für eine maximale Auflösung der Zielzellen erforderlich ist. Dies kann durch Beobachtung der Gradientenform im Röhrchen mit den Dichtemarker-Beads bestätigt werden. Der Gradient wird im fortschreitenden Zeitverlauf immer steiler. Es hat sich gezeigt, dass sich die Form des Gradienten annähernd linear zur gesamten g-Kraft und der Zentrifugationszeit verhält.
Nach der Gradientenbildung kann die isopyknische Bänderung der Zellen durch langsame 15- bis 20-minütige Zentrifugation bei 400 × g erreicht werden. Wenn eine Schätzung der Zelldichte erforderlich ist, wird ein Volumen, das dem der Zellsuspension entspricht, auf das Röhrchen mit den Dichtemarker-Beads geschichtet. Dies dient sowohl zur Abschätzung der Zelldichte als auch als Gegengewicht.
In situ gebildete Gradienten
Die Sedimentationskoeffizienten von subzellulären Partikeln und Viren sind in der Regel zu niedrig, um eine Bänderung auf vorgefertigten Gradienten bei geringen g-Kräften zu ermöglichen. Daher ist es oft zweckmäßig, die Suspension der biologischen Partikel mit Percoll zu mischen und die Partikel auf einem in situ gebildeten Gradienten zu bändern. Die durch Zentrifugation gebildeten Percoll-Gradienten sind metastabil (d. h. sie ändern sich während der Hochgeschwindigkeitszentrifugation kontinuierlich). Die Sedimentationsgeschwindigkeit des Kolloids ist langsam genug, um die Bänderung kleiner Viren und Zellorganellen mit „S“-Werten > 60S zu ermöglichen, während sich der Gradient in situ bildet.
Eine gängige Methode zur Bildung von Gradienten in situ ist die Herstellung einer SIP mit 9 Teilen Percoll auf 1 Teil 2,5 M Saccharose. Die SIP wird dann mit 0,25 M Saccharose auf die gewünschte Dichte verdünnt. (Obwohl für die Herstellung von In-situ-Gradienten in der Regel Saccharose verwendet wird, können auch Zellkulturmedien verwendet werden). Wird die Probe direkt mit Gradientenmaterial gemischt, kann die Auswirkung auf die Gesamtdichte der Percoll-Lösung anhand der Formel auf Seite 13 berechnet werden. Das Vormischen der Probe mit dem Gradientenmaterial ist zweckmäßig, wenn eine genaue Messung der Schwebedichte der Partikel gewünscht wird. Es kann jedoch besser sein, die Versuchsprobe auf das Gradientenmaterial zu schichten, insbesondere in Fällen, in denen eine Trennung subzellulärer Partikel von löslichen Proteinen wünschenswert ist. Die löslichen Proteine verbleiben in der Pufferschicht über dem Gradienten und die subzellulären Partikel trennen sich im Percoll-Gradienten in situ.
Die Zentrifugation muss in einem Winkelkopfrotor durchgeführt werden. Zur Überwachung des Gradienten wird ein Ausgleichsröhrchen eingesetzt, das anstelle der Versuchsprobe Dichtemarker-Beads enthält. Es soll zunächst ein geeigneter Modellversuch, ähnlich dem auf Seite 22, durchgeführt werden, um die Gradientenbildungseigenschaften des zu verwendenden Rotors zu ermitteln.
Maximale Probenbeladung für Percoll-Gradienten
Es gibt keine Standardregeln für die maximale Menge an Zellen oder subzellulärem Material, die auf Percoll-Gradienten getrennt werden können. Bei der subzellulären Fraktionierung kann eine erfolgreiche Aufreinigung mit einer Gesamtbeladung von 1 bis 5 mg Protein in einem Probenvolumen von 0,5 ml auf 10 ml Gradientenmaterial erreicht werden (Pertoft, persönliche Kommunikation).
Ein Modellversuch zur Standardisierung der Bedingungen für Percoll-Gradienten
Die genaue Form und der Bereich der Gradienten, die sich während der Zentrifugation bilden, werden durch das Modell und den Winkel des verwendeten Rotors sowie durch die Größe der Zentrifugenröhrchen beeinflusst. Der folgende Versuch soll es ermöglichen, eine Reihe von Gradientenkurven für einen bestimmten Rotor und bestimmte Röhrchen zu erstellen. Er kann als Referenz für alle zukünftigen Versuche verwendet werden.
Das gewählte Beispiel bezieht sich auf 10-ml-Gradienten, kann aber für größere Röhrchengrößen aufskaliert werden.
- 49,5 ml Percoll mit 5,5 ml 1,5 M NaCl mischen, um eine SIP herzustellen.
- Die SIP aus Schritt 1 mit 0,15 M NaCl mischen, um eine Reihe von 10-ml-Versuchsproben (Gesamtgröße des Zentrifugenröhrchens = 13,5 ml), wie in der folgenden Tabelle dargestellt, herzustellen:
- 10 μl einer Suspension jedes Dichtemarker-Beads-Typs in jedes Röhrchen gemäß den Packungsanweisungen zugeben.
- Die Röhrchen ausbalancieren, verschließen und durch mehrmaliges Umdrehen mischen.
- Die Röhrchen in den Winkelkopfrotor setzen (wenn nur 8 Plätze vorhanden sind, Röhrchen 1 und 10 weglassen).
- 15 min bei 30 000 × g zentrifugieren.
- Die Röhrchen vorsichtig herausnehmen und mit Millimeterpapier den Abstand jedes Bandes vom Boden des Röhrchens auf 0,5 mm genau messen.
- Die Gradientenform jedes Röhrchens plotten, indem jedes Band mit der genauen Schwebedichte für jedes Markierungs-Bead kalibriert wird.
- Den Inhalt jedes Röhrchens durch Umdrehen erneut mischen und die Zentrifugation wiederholen, diesmal bei 60 000 × g für 15 Minuten.
- Die Gradienten messen und die Ergebnisse wie zuvor plotten. Die genaue Dichte der Verdünnung anhand der Formel berechnen (Seite 13). In den Abbildungen 9 und 10 werden typische Beispiele für eine Reihe von Kurven aufgezeigt, die mit Percoll in 0,15 M NaCl erstellt wurden.
Der Versuch kann unter Verwendung von Percoll in 0,25 M Saccharose wiederholt werden; in diesem Fall sollen die Laufbedingungen 50 000 × g für 25 min gefolgt von 100 000 × g für 25 min betragen.
Den G-Kraft-Rechner einsetzen, um Umdrehungen pro Minute (U/min) in relative Zentrifugalkraft (RCF) oder g-Kraft umzurechnen.
Um weiterzulesen, melden Sie sich bitte an oder erstellen ein Konto.
Sie haben kein Konto?