616371
Aprotinin, Bovine, Recombinant, Nicotiana sp., Animal-Free
recombinant, expressed in Nicotiana, heat and acid-stable competitive, reversible inhibitor of serine proteases
Synonyme(s) :
Aprotinin, Bovine, Recombinant, Nicotiana sp., Animal-Free, Pancreatic Trypsin Inhibitor, Trypsin-Kallikrein Inhibitor, Kallikrein-Trypsin Inactivator, Antikrein, Basic Pancreatic Trypsin Inhibitor
About This Item
Produits recommandés
Produit recombinant
expressed in Nicotiana
Niveau de qualité
Pureté
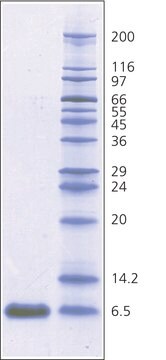
≥98% (SDS-PAGE)
Forme
powder
Activité spécifique
≥5.0 units/mg protein
Fabricant/nom de marque
Calbiochem®
Conditions de stockage
OK to freeze
Couleur
white to off-white
Conditions d'expédition
wet ice
Température de stockage
2-8°C
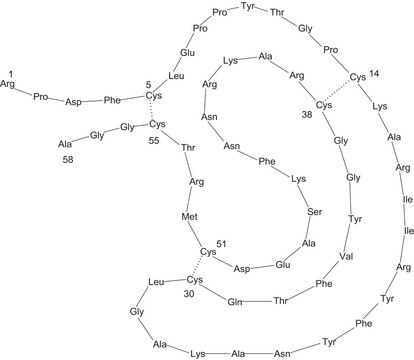
Description générale
Actions biochimiques/physiologiques
chymotrypsin
Conditionnement
Avertissement
Définition de l'unité
Forme physique
Autres remarques
Informations légales
Code de la classe de stockage
12 - Non Combustible Liquids
Classe de danger pour l'eau (WGK)
nwg
Point d'éclair (°F)
Not applicable
Point d'éclair (°C)
Not applicable
Certificats d'analyse (COA)
Recherchez un Certificats d'analyse (COA) en saisissant le numéro de lot du produit. Les numéros de lot figurent sur l'étiquette du produit après les mots "Lot" ou "Batch".
Déjà en possession de ce produit ?
Retrouvez la documentation relative aux produits que vous avez récemment achetés dans la Bibliothèque de documents.
Les clients ont également consulté
Notre équipe de scientifiques dispose d'une expérience dans tous les secteurs de la recherche, notamment en sciences de la vie, science des matériaux, synthèse chimique, chromatographie, analyse et dans de nombreux autres domaines..
Contacter notre Service technique