MAB1913-C
Anticuerpo anti-procolágeno de tipo I, CT, clon PCIDG10 (sin ascitis)
clone PCIDG10, from mouse
Sinónimos:
Collagen alpha-1(I) chain, Procollagen Type I, CT, Alpha-1 type I collagen
About This Item
Productos recomendados
biological source
mouse
Quality Level
antibody form
purified immunoglobulin
antibody product type
primary antibodies
clone
PCIDG10, monoclonal
species reactivity
mouse, human, rat, guinea pig
species reactivity (predicted by homology)
bovine (based on 100% sequence homology)
technique(s)
ELISA: suitable
flow cytometry: suitable
immunocytochemistry: suitable
immunohistochemistry: suitable (paraffin)
isotype
IgG1κ
NCBI accession no.
UniProt accession no.
shipped in
dry ice
target post-translational modification
unmodified
Gene Information
human ... COL1A1(1277)
General description
Specificity
Immunogen
Application
Análisis mediante inmunocitoquímica: un lote representativo detectó inmunorreactividad del procolágeno tipo I en fibroblastos de tendón semitendinoso y gracilis humanos de pacientes sometidos a cirugía de reconstrucción tras ruptura del ligamento cruzado anterior (LCA) mediante inmunocitoquímica fluorescente (Bayer, M.L., et al (2012). Mech Ageing Dev. 133(5):246-254).
Análisis mediante citometría de flujo: un lote representativo detectó fibrocitos PICP+/CD45+ en células pulmonares de ratones tratados con bleomicina (Yeager, M.E., et al (2012). Eur Respir J. 39(1):104-111).
Análisis mediante citometría de flujo: un lote representativo detectó números y porcentajes más elevados de fibrocitos PICP+/CD45+ circulantes en muestras de sangre periférica de niños/jóvenes con hipertensión pulmonar (PH) que en muestras de individuos sanos (Reese, C., et al (2014). Front Pharmacol. 5-141).
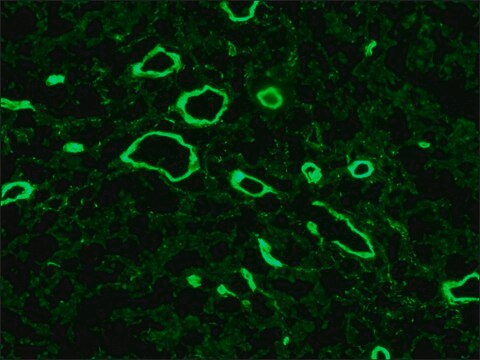
Análisis mediante Inmunohistoquímica: un lote representativo detectó inmunorreactividad del procolágeno tipo I citoplásmico en células del estroma de lisado funcional de cortes de endometrio menstrual humano congelado (Gaide Chevronnay, H.P., et al (2009). Endocrinology. 150(11):5094-5105).
Análisis ELISA: un lote representativo detectó una diferente dependencia de la edad de la inmunorreactividad del propéptido C-terminal del procolágeno tipo I (PICP) en los ligamentos cruzados de cobayas Dunkin-Hartley (DH) propensas a artrosis y en cobayas de control de la cepa Bristol 2 (BS2) de edad semejante (Quasnichka, H.L., et al (2005). Arthritis Rheum. 52(10):3100-3109).
Estructura celular
Adherencia (CAM)
Quality
Análisis mediante inmunohistoquímica: una dilución 1:50 de este anticuerpo detectó el procolágeno tipo I en tejido óseo humano.
Target description
Physical form
Storage and Stability
Recomendaciones de manipulación: Tras su recepción, y antes de quitar la tapa, centrifugue el vial y mezcle suavemente la disolución. Distribúyalo en alícuotas en tubos de microcentrífuga y guárdelo a -20°C. Evite ciclos repetidos de congelación y descongelación que pueden dañar la IgG y afectar al rendimiento del producto.
Other Notes
Disclaimer
¿No encuentra el producto adecuado?
Pruebe nuestro Herramienta de selección de productos.
Storage Class
12 - Non Combustible Liquids
wgk_germany
WGK 1
flash_point_f
Not applicable
flash_point_c
Not applicable
Certificados de análisis (COA)
Busque Certificados de análisis (COA) introduciendo el número de lote del producto. Los números de lote se encuentran en la etiqueta del producto después de las palabras «Lot» o «Batch»
¿Ya tiene este producto?
Encuentre la documentación para los productos que ha comprado recientemente en la Biblioteca de documentos.
Nuestro equipo de científicos tiene experiencia en todas las áreas de investigación: Ciencias de la vida, Ciencia de los materiales, Síntesis química, Cromatografía, Analítica y muchas otras.
Póngase en contacto con el Servicio técnico