Eau ultra pure pour des milieux de culture exempts de BPA
Merina Corpinot, PhD1, Maurizio Zuccotti, PhD2, Daniel Darbouret, PhD1
1R&D Department, Lab Water Solutions, Merck, Guyancourt, France, 2Laboratory of Developmental Biology, Department of Biology and Biotechnology “Lazzaro Spallanzani”, University of Pavia, Italy
L'objectif de cette étude était d'établir une technique permettant de détecter de faibles niveaux de bisphénol A (BPA), un perturbateur endocrinien, dans l'eau et, plus précisément, de documenter la manière dont un système de purification d'eau Milli-Q® IQ 7000 équipé d'un ultrafiltre Biopak® (configuration recommandée pour les applications de biologie moléculaire) produit une eau ultra pure de référence qui convient à la recherche en embryologie sensible au BPA.
Pour en savoir plus
- Problèmes de santé liés aux perturbateurs endocriniens tels que le bisphénol A
- Étude 1 : HP-SPME-GC-MS pour mesurer le BPA dans l'eau ultra pure utilisée dans la recherche en embryologie
- Étude 2 : eau ultra pure exempte de BPA pour les analyses cytologiques et moléculaires destinées à évaluer l'incidence du BPA sur la maturation des ovocytes.
- Étude 3 : eau ultra pure exempte de BPA pour les milieux utilisés dans la technologie d'imagerie cellulaire
- Conclusion : une eau ultra pure pour les applications sensibles au BPA dans les études sur l'embryogenèse
- Matériels et méthodes pour l'analyse du BPA par HP-SPME-GC-MS
- Produits apparentés
Problèmes de santé liés aux perturbateurs endocriniens tels que le bisphénol A
Les perturbateurs endocriniens sont des substances chimiques qui interfèrent avec le système endocrinien des humains et des animaux. Ils affectent la croissance, ainsi que les systèmes reproductif, immunitaire et nerveux, entraînant des conséquences néfastes pour la santé. Présents dans les plastiques (y compris dans les consommables et équipements de laboratoire), les laques, les résines et les tensioactifs, les perturbateurs endocriniens sont considérés comme omniprésents.
Des normes et des règlements régissent les doses maximales de perturbateurs endocriniens autorisées dans les produits alimentaires et les boissons, ainsi que leur présence dans l'environnement. Parmi les différents perturbateurs endocriniens produits industriellement, le BPA est l'un des plus répandus. Le BPA est connu comme un "xéno-œstrogène", car il imite l'hormone œstrogène, et soulève donc des préoccupations majeures en matière de santé. Plusieurs études ont confirmé que le BPA interfère avec la production d'hormones et l'expression de leurs gènes. Des recherches récentes ont révélé que même de faibles niveaux de BPA (20 µg/kg/jour, ce qui représente une dose de BPA pertinente sur le plan environnemental pendant une semaine d'exposition du fœtus) peuvent affecter la production d'ovocytes sains (Figure 1), en interférant avec leur croissance à l'intérieur de l'ovaire.1-3
L'objectif des études décrites ci-dessous était de démontrer que la qualité de l'eau ultra pure (Type 1) obtenue à partir d'un système de purification d'eau Milli-Q® convient à la préparation de milieux et de solutions qui garantissent l'absence de BPA, en particulier un environnement de culture sans BPA pour les expériences de biologie de la reproduction.
- L'Étude 1 montre les résultats de l'analyse du BPA dans différents types d'eau à l'aide de la micro-extraction en phase solide à haute performance couplée à la chromatographie en phase gazeuse et à la spectrométrie de masse (HP-SPME-GC-MS).
- L'Étude 2 présente les résultats d'analyses cytologiques et moléculaires destinées à évaluer l'incidence du BPA sur la maturation des ovocytes.
- L'Étude 3 montre l'importance de l'eau pour les milieux de culture utilisés dans la technologie d'imagerie cellulaire.
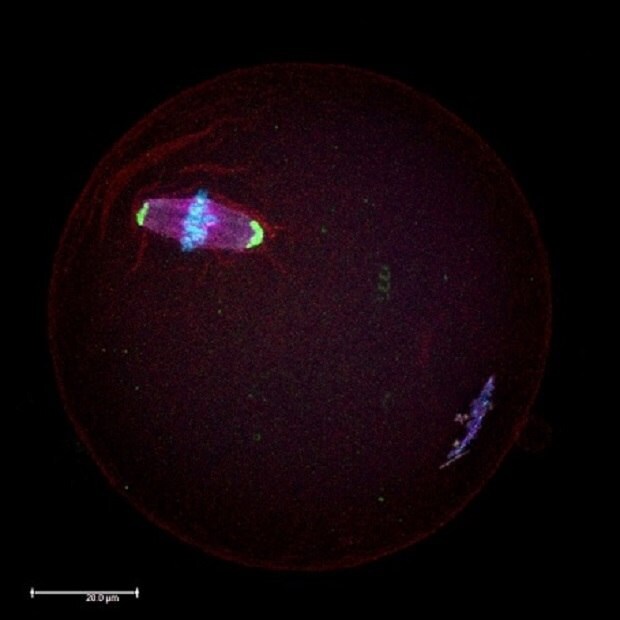
Figure 1.Analyse par immunocytochimie microscopique d'un ovocyte de souris au stade méiotique de la métaphase II (MII) à l'aide d'anticorps dirigés contre les protéines des fuseaux méiotiques (en rouge) et des centrosomes (en vert). Les chromosomes sont contre-colorés en bleu au diamidinophénylindole (DAPI).
Étude 1 : HP-SPME-GC-MS pour mesurer le BPA dans l'eau ultra pure utilisée dans la recherche en embryologie
En biologie de la reproduction, l'eau est un réactif essentiel pour effectuer des analyses (p. ex. pour la préparation des milieux de culture).
Des scientifiques de l'université de Pavie, en Italie, ont utilisé une méthode reproductible par HP-SPME-GC-MS pour analyser la teneur en BPA de l'eau ultra pure utilisée dans le cadre de leurs recherches en embryologie. L'eau ultra pure analysée provenait d'un système de purification d'eau ultra pure Milli-Q® IQ 7000 alimenté par de l'eau pure Elix® produite par un système qui utilise une combinaison de technologies de purification, notamment l'osmose inverse (OI) évoluée, l'électrodésionisation (EDI) Elix® et une lampe UV bactéricide, similaire à un système de purification d'eau Milli-Q® HX. Le système d'eau ultra pure Milli-Q® IQ 7000 était équipé d'un polisseur Biopak® au point d'utilisation (Figure 2). Le polisseur par ultrafiltration Biopak® est recommandé pour les applications de biologie moléculaire afin de fournir une eau exempte d'endotoxines, de nucléases, de protéases et de bactéries.

Figure 2.Aperçu de l'analyse expérimentale du Bisphénol A (BPA) dans différents types d'eau de laboratoire à l'aide de la méthode HP-SPME-GC-MS.
L'analyse par HP-SPME-GC-MS a montré que le BPA n'était pas détectable dans l'eau pure Elix® ni dans l'eau ultra pure Milli-Q® utilisées pour alimenter les expériences du laboratoire, dans une limite de détection (LD) de 4 nM (Tableau 1).
Comme indiqué, l'eau expérimentale a été distribuée à partir d'un polisseur Biopak®. La Figure 3 montre un résultat typique obtenu en analysant trois échantillons d'eau distribués consécutivement par un système Milli-Q® IQ 7000 équipé d'un polisseur Biopak® au point d'utilisation. La répétabilité et la robustesse de l'analyse GC-MS, ainsi que les variations quotidiennes du BPA, ont été évaluées conformément aux procédures décrites dans la section "Matériel et méthodes" ci-dessous.
Les résultats démontrent que la qualité de l'eau ultra pure obtenue avec le système Milli-Q® IQ 7000 ne contient pas de BPA détectable (LD = 4 nM). L'analyse a notamment montré que le BPA n'est pas libéré par le système dans l'eau produite, car il n'était pas détectable dans l'eau de ville alimentant le système de purification d'eau.
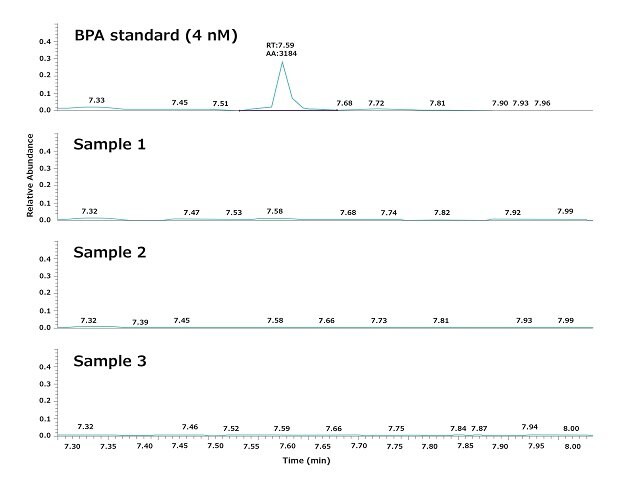
Figure 3.Chromatogrammes montrant les niveaux de BPA dans trois échantillons d'eau ultra pure. Des échantillons ont été prélevés consécutivement au point d'utilisation d'un système d'eau ultra pure Milli-Q® IQ 7000 équipé d'un polisseur Biopak®.
Les deux études suivantes révèlent qu'un système de purification d'eau ultra pure Milli-Q® peut être utilisé en toute confiance pour distribuer de l'eau de haute qualité exempte de contamination par le BPA et peut être utilisé pour étudier les effets des perturbateurs endocriniens sur les gamètes et les embryons en développement, en particulier l'eau prélevée après le polisseur Biopak®.
Étude 2 : eau ultra pure exempte de BPA pour les analyses cytologiques et moléculaires destinées à évaluer l'incidence du BPA sur la maturation des ovocytes.
Pour mesurer l'impact d'une molécule particulière, l'environnement expérimental doit être exempt de la molécule en question. Dans l'étude présentée, les scientifiques ont utilisé la RT-qPCR pour analyser l'expression des transcriptions de quatre gènes à effet maternel, Brg1 (remodelage de la chromatine), Dnmt3a et Dnmt3l (méthylases de l'ADN), et Oct-4 (marqueur de la pluripotence cellulaire). Les échantillons étaient constitués de trois pools indépendants de 10 ovocytes de souris en métaphase II (MII), obtenus après 15 heures de maturation in vitro (MIV) de follicules antraux entièrement développés en présence de 10 nM, 100 nM ou 1000 nM de BPA.
Les résultats ont révélé que le BPA n'a pas arrêté la maturation méiotique aux trois doses testées, la grande majorité (96,5 %) des ovocytes ayant atteint le stade MII, sans différence significative entre les témoins (CTR) et les échantillons exposés. Cependant, l'expression de tous les gènes testés a été significativement modifiée (à la hausse ou à la baisse comparée à celle du contrôle non traité) à toutes les concentrations de BPA testées, à l'exception de Oct-4 qui n'a pas été modifié à 10 nM de BPA (Figure 4).
Ces mesures de l'expression génique ont été réalisées en utilisant de l'eau ultra pure distribuée par un système de purification d'eau Milli-Q® IQ 7000 équipé d'un polisseur Biopak®. Les résultats confirment que l'eau ultra pure distribuée par ce système Milli-Q® peut être utilisée dans des applications sensibles au BPA dans le domaine de la biologie de la reproduction.
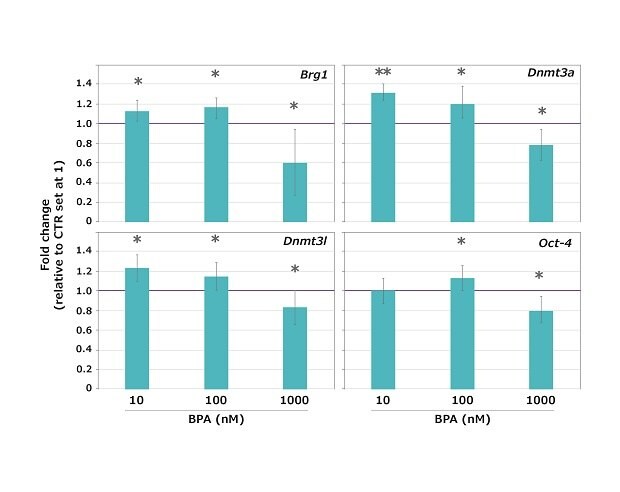
Figure 4.Profils d'expression des gènes Brg1, Dnmt3a, Dnmt3l et Oct-4 à effet maternel dans des ovocytes de souris exposés à 10, 100 ou 1 000 nM de BPA pendant la transition GV-MII. Les valeurs d'expression des échantillons de contrôle (CTR) ont été fixées à 1 pour le calcul de la variation du facteur n. Les valeurs sont exprimées sous la forme d'une moyenne ± écart-type *p < 0,05 **p < 0,001.
Étude 3 : eau ultra pure exempte de BPA pour les milieux utilisés dans la technologie d'imagerie cellulaire
L'imagerie en accéléré permet d'observer les mouvements qui se produisent à l'intérieur d'un ovocyte lors de son passage de la vésicule germinative (VG ou GV en anglais) au stade MII du développement (vidéo4). Ces mouvements, connus sous le nom de vitesse de mouvement cytoplasmique, servent de marqueur cytologique non invasif pour évaluer la compétence de développement d'un gamète femelle (la qualité et la capacité d'un gamète à poursuivre son développement).5,6 Dans l'étude présentée, cette nouvelle technique a été utilisée pour étudier le mouvement cytoplasmique au cours de la transition GV-MII d'ovocytes mûris en absence ou en présence de concentrations croissantes de BPA (la Figure 5 montre des données représentatives pour 100 nM de BPA uniquement).
L'analyse de la vélocimétrie par images de particules (PIV) cellulaires a montré que les ovocytes étaient sensibles aux doses de BPA testées pendant des périodes spécifiques du développement. Fait remarquable, lors de l'exposition à la faible concentration de 10 nM de BPA, les altérations de la vitesse du mouvement cytoplasmique étaient dispersées en des points temporels uniques, tandis qu'à des doses plus élevées, ces altérations étaient visibles pendant un laps de temps prolongé au cours de la transition GV-MI. Plus précisément, une dose de 100 nM de BPA a entraîné des différences significatives dans un intervalle de temps où la chromatine se condense et où les centromères s'agrègent en grands chromocentres pour former la plaque MI (Figure 5).
Les milieux de culture utilisés dans les expériences ci-dessus ont été préparés avec de l'eau ultra pure provenant d'un système de purification d'eau Milli-Q® IQ 7000 équipé d'un polisseur Biopak®. Les résultats soulignent la nécessité de disposer de milieux de culture sans BPA, car même de faibles doses de 100 nM de BPA peuvent avoir des effets, détectés soit par l'analyse de l'expression des gènes soit par celle des mouvements cytoplasmiques (MC).
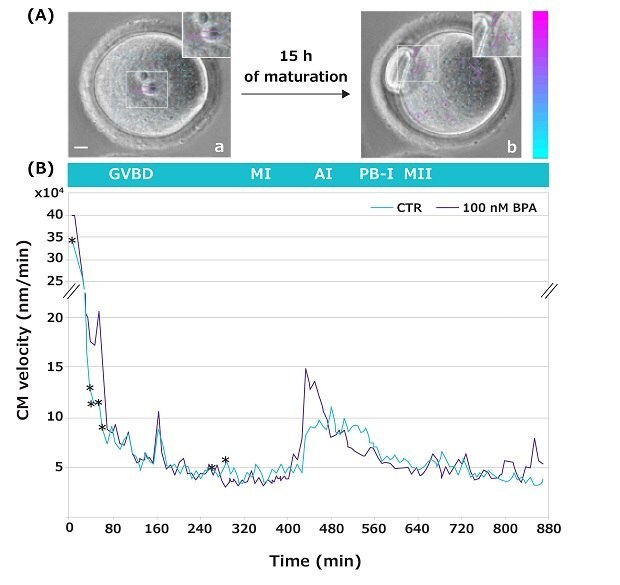
Figure 5.(A) Images représentatives d'un ovocyte GV, prises à l'image 1 (a) et d'un ovocyte MII à l'image 100 (b). Les encarts montrent des images agrandies avec des flèches (vecteurs de vitesse) indiquant l'intensité et la direction des mouvements cytoplasmiques. La couleur et la longueur des flèches indiquent le module de vitesse des mouvements par rapport à l'image précédente. Barre d'échelle vectorielle colorée (nm/min) : le bleu indique une faible vitesse ; le violet indique une vitesse élevée. Barre : 10 µm. (B) Profil des mouvements cytoplasmiques pendant la transition GV-MII d'ovocytes de souris en l'absence (vert) ou en présence (gris) de 100 nM de BPA. *p < 0,05.
Conclusion : une eau ultra pure pour les applications sensibles au BPA dans les études sur l'embryogenèse
La sensibilité et les performances croissantes des techniques de recherche exigent une eau purifiée de haute qualité pour éviter toute contamination susceptible de compromettre la précision et l'authenticité des résultats expérimentaux. Les scientifiques ont besoin d'une eau de haute pureté, en particulier pour les études impliquant des outils d'investigation très pointus, afin d'éviter tout problème susceptible de perturber leurs résultats (p. ex. BPA, endotoxines, nucléases, protéases et bactéries) et d'avoir une plus grande confiance dans leurs analyses expérimentales.
Dans le domaine de l'embryologie, il a été démontré que même de faibles niveaux de BPA, un perturbateur endocrinien, compromettent la recherche en embryologie en interférant avec la croissance des ovocytes. Cette situation est préoccupante car le BPA, même s'il n'est pas nécessairement présent à l'origine dans l'eau de ville d'un laboratoire, peut être libéré par les consommables et les équipements de laboratoire et perturber les résultats expérimentaux.
Dans cet article, bien que nous ayons montré que de faibles niveaux de BPA n'arrêtaient pas la maturation méiotique, une très faible concentration de BPA de seulement 10 nM a eu une incidence à la fois sur l'expression des gènes et sur les mouvements qui se produisent à l'intérieur d'un ovocyte pendant sa transition de la vésicule germinative (VG) au stade MII du développement. Ces résultats soulignent la nécessité de réaliser des expériences d'embryologie dans un environnement sans BPA, notamment en utilisant de l'eau ultra pure dont la teneur en BPA est garantie non détectable.
Il a été démontré que l'eau ultra pure fournie par un système de purification d'eau ultra pure Milli-Q® IQ 7000 équipé d'un polisseur Biopak® ne contenait pas de BPA détectable, à une limite de détection même très basse de seulement 4 nM, selon la méthode utilisée dans cet article. L'eau ultra pure fournie par ce système peut donc être utilisée en toute confiance pour étudier les effets des perturbateurs endocriniens sur les gamètes et les embryons en développement.
Pour trouver des solutions de purification d'eau adaptées aux exigences des analyses sensibles au BPA, demandez l'assistance d'un expert en purification d'eau.
Matériels et méthodes pour l'analyse du BPA par HP-SPME-GC-MS
Instruments
- Un système de GC-MS Thermo Scientific DSQII à quadripôle unique (spectromètre de masse TraceDSQII, chromatographe en phase gazeuse TraceGCUltra) équipé d'un échantillonneur automatique CombiPAL (CTC Analytics, Suisse) a été utilisé pour effectuer l'analyse de l'eau.
- Une colonne capillaire Restek Rxi™ - 5 ms (5 % diphényle/95 % diméthylpolysilane - Restek Corporation, Bellefonte, USA) de 30 mm de longueur, 0,25 de D.I., 0,25 µm d'épaisseur de film a été utilisée avec de l'hélium comme gaz vecteur à un débit constant de 1,0 ml/min.
- Des fibres SPME en polydiméthylsiloxane (PDMS) de 100 µm ont été utilisées. Les fibres ont été nettoyées avant chaque analyse pendant 20 minutes dans un chauffe-aiguille à 250 °C afin d'éviter la contamination croisée avec l'analyse précédente.
Préparation de l'étalon
Une solution mère de BPA à une concentration de 10 nM a été préparée dans de l'éthanol à 100 %. Une série de dilutions a été réalisée pour obtenir une courbe d'étalonnage avec quatre niveaux de concentration différents, 1, 2, 4, 40 nmol/l en utilisant de l'eau pour HPLC.
Expérience 1 : évaluation de la répétabilité et de la robustesse de l'analyse par GC-MS
Trois échantillons d'eau (5 ml) ont été prélevés consécutivement dans chacune des trois sources suivantes : eau de ville, eau pure Elix® et au point d'utilisation d'un système d'eau ultra pure Milli-Q® IQ 7000 équipé d'un polisseur Biopak®. Avant le recueil des échantillons, 5 litres d'eau avaient été distribués pour rincer le système.
Expérience 2 : évaluation des variations journalières de la concentration en BPA
Trois échantillons d'eau (5 ml) ont été prélevés dans l'eau de ville, l'eau pure Elix® et au point d'utilisation d'un système d'eau ultra pure Milli-Q® IQ 7000 équipé d'un polisseur Biopak®, toutes les 24 h pendant trois jours. Avant le recueil des échantillons, 5 litres d'eau avaient été distribués. Des chromatogrammes sont disponibles sur demande.
Échantillons d'eau
Un volume de 5 ml d'eau à analyser (appelée eau de ville, eau pure Elix® et eau ultra pure filtrée sur Biopak®) a été ajouté dans des flacons en verre de 20 ml. Dans chaque flacon, 200 mg de KHCO3, 1 g de NaCl et un barreau d'agitation magnétique à usage unique avaient été ajoutés.
Dérivatisation
30 µl d'anhydride acétique ont été ajoutés à l'échantillon d'eau et les flacons ont été scellés avec un bouchon en aluminium pour espace de tête muni d'un septum en polytétrafluoroéthylène. Une réaction complète a été obtenue avec un temps de réaction de dérivatisation de 5 min à 80 °C (avec une agitation continue à 50 tr/min). L'extraction du BPA dans l'espace de tête a été réalisée à l'aide de des fibres PDMS de 100 µm à 80 °C pendant 30 min sous agitation (500 tr/min). Les fibres SPME ont été désorbées dans l'injecteur à 250 °C pendant 2 minutes.
Analyse chromatographique
La température du four a été maintenue à 150 °C pendant 2 minutes, puis augmentée de 30 °C/min jusqu'à 280 °C et maintenue pendant 6 minutes. L'injection a été réalisée en mode splitless (sans division du flux), le temps splitless étant de 2 minutes et la température de l'injecteur PTV maintenue à 250 °C. La ligne de transfert a été maintenue à 290 °C et la source d'ions à 250 °C. La MS a été utilisée en mode d'ionisation à impact électronique (EI) et les ions ont été enregistrés à la fois en mode de balayage complet, avec une plage de masse de m/z de 35 à 350 amu, et en mode SIM (Selected Indicators Monitoring, suivi d'indicateurs choisis), en utilisant le m/z 270 comme ion quantificateur pour le BPA.
Remerciements
Les auteurs remercient le laboratoire de biologie du développement de l'Université de Pavie (Italie) pour la réalisation de cette recherche et nos collègues de la R&D pour leur contribution à ce projet.
Références bibliographiques
Pour continuer à lire, veuillez vous connecter à votre compte ou en créer un.
Vous n'avez pas de compte ?