Anleitung für die Fehlerbehebung in der HPLC
Identifizieren, Isolieren und Korrigieren der am häufigsten in der HPLC auftretenden Fehler
Obwohl die Entwicklung von HPLC-Methoden durch Fortschritte in der Säulentechnologie und im Bereich von Instrumenten verbessert wurde, treten immer noch Probleme auf. In jedem Leitfaden zur Fehlersuche wird die Reproduzierbarkeit der Selektivität als wichtigstes Säulenkriterium genannt, weshalb die meisten Hersteller alles daran setzen, ihre Produktionsprozesse zu validieren. Dennoch zeigen sich in der Oberflächenchemie oft erst bei der Analyse sehr empfindlicher Proben kleine Unterschiede. Es ist praktisch unmöglich, alle diese Faktoren während der Produktion zu eliminieren, da es viele Variablen gibt: Rohmaterialien und Reagenzien, die Chemie der Oberflächenbindung, das Verfahren selbst sowie der Säulenpacker, die Geräteausstattung und die Umgebung. Hinzu kommt, dass sich die Oberflächenchemie der Säule während des Gebrauchs zumeist verändert. Die gebundene Phase wird abgebaut, Siliciumdioxid löst sich zu Silicat auf, und die erweiterte Oberfläche neigt dazu, Verunreinigungen aus der Probe und der mobilen Phase zu adsorbieren. Diese kleinen Unterschiede müssen daher durch die Robustheit der Methode kompensiert werden.
In diesem Leitfaden bieten wir Ihnen eine systematische Methode zur Isolierung, Erkennung und Behebung vieler typischer HPLC-Probleme.
Das Wichtigste ist, dass Sie sich vier einfache Grundregeln zu Herzen nehmen:
- Die Regel der „Eins“: Ändern Sie nie mehr als einen Faktor auf einmal. Wenn Sie mehrere Änderungen gleichzeitig vornehmen, ist es schwierig zu spekulieren, von welcher Änderung die Wirkung ausgeht.
- Die zweite Regel: Jeder Effekt oder jedes Problem muss wiederholbar sein, damit man es behandeln kann. Wenn ein chromatographisches Problem nicht wiederholbar ist, ist es sehr schwierig, die Ursache und ihre Behebung zu erkennen.
- „Put it back“: Letztlich lassen sich viele Probleme durch regelmäßige Routinewartung (z. B. planmäßigen Austausch verschlissener Teile) vermeiden, und es lohnt sich, zu dokumentieren, was wann unternommen wurde.
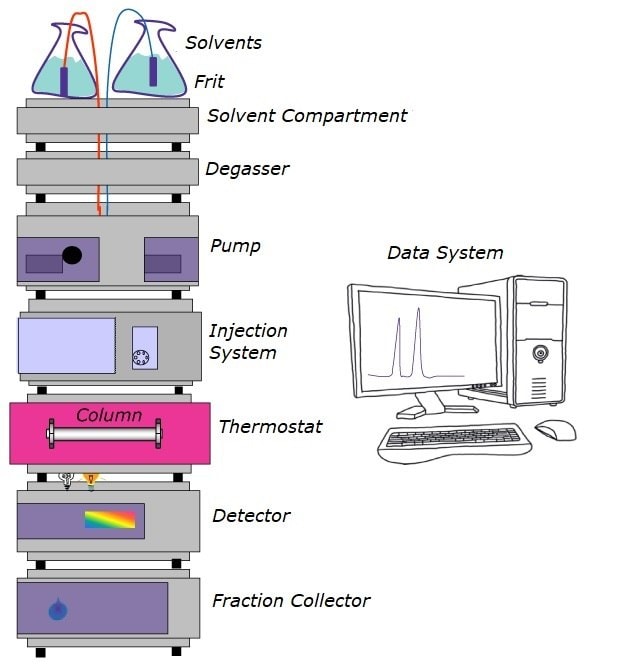
Der Grundaufbau eines HPLC-Systems ist immer der gleiche, unabhängig davon, ob ein modulares System oder eine komplexere Einheit eingesetzt wird. Probleme, welche die Gesamtleistung des Systems beeinträchtigen, können in jeder Komponente auftreten. Einige häufig auftretende Probleme und Fragen und deren Behebung werden hier erörtert. Als Chromatograph muss man häufig Probleme erkennen und beheben. Sie lassen sich in verschiedene Kategorien einteilen. Die Lösungen für diese Probleme werden in übersichtlichen Tabellen dargestellt.
ISOLIERUNG VON HPLC-PROBLEMEN
In einem HPLC-System können viele Quellen Ursachen für Probleme darstellen. Zunächst definieren Sie das Problem. Danach isolieren Sie die Ursache.
Verwenden Sie Tabelle 1, um festzustellen, welche Komponente(n) das Problem verursacht(en). Mit einem Ausschlussverfahren kann in der Regel die genaue Ursache ermittelt und das Problem behoben werden.
Möchten Sie Ihre HPLC-Methode in eine UHPLC-Methode übertragen? Unser Rechner für den HPLC-Methodentransfer unterstützt Sie bei der Berechnung der Laufzeit- und Lösungsmittelverbrauchseinsparungen durch den Methodentransfer.
WIE MAN PROBLEME MIT DER MOBILEN PHASE VERMEIDET
Der wichtigste Teil einer Chromatographie-Anlage ist die Säule. Aber auch wenn sie eine Retention vorsieht, hängt die letztliche Trennung stark von der mobilen Phase (MP) ab. Die verschiedenen Effekte, die die mobile Phase bietet, beeinflussen die Retention und die differentielle Migration (Selektivität) der gelösten Stoffe durch die Säule. Geringe Empfindlichkeit und ansteigende Basislinien, Rauschen oder Spikes im Chromatogramm sind oft auf die Verunreinigung der mobilen Phase zurückzuführen. Verunreinigungen in der mobilen Phase sind bei der Gradientenelution besonders problematisch, da sich auch kleinste Verunreinigungen im Laufe der Zeit ansammeln können und sozusagen auf die erhöhte Elutionskraft der mobilen Phase warten, um zu eluieren. Die Basislinie kann ansteigen, und es können falsche Peaks auftreten, wenn der Gehalt des kontaminierten Bestandteils zunimmt.
Häufig sind Probleme bei der chromatographischen Trennung auf eine falsch oder inkonsistent vorbereitete mobile Phase zurückzuführen. Aus praktischen Gründen (z. B. in der klinischen Diagnose oder in der Prozesskontrolle) ist daher eine Tendenz zur Verwendung einfacherer mobiler Phasen zu beobachten, um die Robustheit der Methode zu erhöhen, den Methodentransfer zu erleichtern und den Gebrauch zu vereinfachen.
Reinheit der Lösungsmittel/des Additivs zur mobilen Phase
Wahrscheinlich kennen Sie die Regel „Garbage in, garbage out“. Diese Redewendung trifft auf die Wahl der richtigen Reinheit der Komponenten der mobilen Phase besonders zu. So ist es zum Beispiel ein absolutes Muss, für Gradiententrennungen Lösungsmittel und Reagenzien in Gradientenqualität zu verwenden, um eine genaue, reproduzierbare und saubere Basislinie (frei von Geisterpeaks) und eine empfindliche chromatographische Trennung zu erhalten. Der Gebrauch der richtigen und geeigneten Lösungsmittelqualität abhängig von der Anwendung (z. B. Hochleistungsqualität für LC-MS-Methoden; mehr dazu unter SigmaAldrich.com/Solvents) minimiert auch die Gefahr von Verunreinigungen und verlängert die Lebensdauer einer Chromatographiesäule. Wasser ist die häufigste Kontaminationsquelle bei Umkehrphasenanalysen. Zur Formulierung mobiler Phasen nur hochreines (z. B. Milli Q), destilliertes, doppelt destilliertes oder entionisiertes Wasser verwenden. Milli-Q®-Systeme sind die beste Wahl für Chromatographen, da sie eine einzigartige Kombination aus optimierten Wasseraufbereitungs- und Überwachungstechnologien bieten. Die Wahl des richtigen Typ-1-Wassersystems für Ihr Labor hängt von mehreren Parametern ab, wie z. B. der verfügbaren Speisewasserqualität, dem täglichen Volumenbedarf, Überwachungsanforderungen, erwarteten Zertifizierungsniveaus und eventuell bestehenden anderen spezifischen Anforderungen. Wenn Sie destilliertes oder deionisiertes Wasser verwenden, denken Sie daran, dass herkömmliche Deionisierer organische Verunreinigungen in das Wasser einbringen können. Um diese Verunreinigungen zu entfernen, wird das entionisierte Wasser durch Aktivkohle oder eine präparative C18-Säule geleitet. Alternativ ist in LC-MS-Qualität abgefülltes Wasser im Handel erhältlich, das die höchste Reinheit auf dem Markt bietet.
Ausschließlich Lösungen in HPLC- (oder LC-MS-) Qualität, Salze, Ionenpaar-Reagenzien sowie Basen- und Säuremodifikatoren verwenden. Die Reinigung von minderwertigen Lösungsmitteln ist zeitaufwändig und oft bleiben Spuren von Verunreinigungen zurück. Diese Spurenverunreinigungen können Probleme verursachen, wenn Sie einen hochempfindlichen Ultraviolett-, Fluoreszenz- oder Massenspektrometriedetektor (MS) verwenden. Wenn Sie die Massenspektrometrie als Enddetektor verwenden, sollten Sie Lösungsmittel und Additive in MS-Qualität verwenden, um die höchstmögliche Gesamtempfindlichkeit der Methode zu gewährleisten und eine Kontamination des MS-Geräts zu vermeiden.
Da viele wässrige Puffer das Wachstum von Bakterien oder Algen fördern, sollten Sie diese Lösungen frisch zubereiten und vor dem Gebrauch mit einem 0,22-μm-Membranfilter filtern (für eine UHPLC-Analyse) oder mit einem 0,45-μm-Filter (für eine Standard-HPLC-Analyse). Durch das Filtern werden auch Partikel entfernt, die eine verrauschte Basislinie erzeugen oder die Säule verstopfen könnten. Das Wachstum von Mikroorganismen lässt sich durch Zugabe von etwa 100 ppm Natriumazid zu wässrigen Puffern verhindern. Alternativ können diese Puffer auch mit 20 % oder mehr eines organischen Lösungsmittels wie Ethanol, Acetonitril, Methanol oder Isopropanol gemischt werden.
In Fällen, die die Zugabe von Reagenzien wie Puffer erfordern, ist darauf zu achten, dass das Reagenz die erforderliche Qualität aufweist und sein Verfallsdatum nicht überschritten hat. Die Abbauprodukte von abgelaufenen Zusatzstoffen führen zu Geisterpeaks in den Probenchromatogrammen. Bestimmte Zusatzstoffe bauen sich je nach ihrer Beschaffenheit schneller ab (z. B. Phosphatpuffer mit 20 mM, pH-7). Eine unsachgemäße/unvorsichtige Handhabung (z. B. Lösungsmittelreste zurück in die Flasche geben, Flasche unverschlossen auf dem Labortisch stehen lassen, verlorene Pipettenspitzen, die in der Flasche schwimmen, usw.) dieser Reagenzien führt schnell zum Verderben der Chemikalien.
Mischen der mobilen Phasen
Bei isokratischen Trennungen mit vorgemischten mobilen Phasen sind während der Herstellung der üblicherweise verwendeten Mischungen (Wasser/Acetonitril, Methanol oder Tetrahydrofuran) die Volumenkontraktionen der Lösungsmittel zu berücksichtigen. Die einzige korrekte Methode zur Herstellung solcher Mischungen mobiler Phasen besteht darin, genau abgemessene Volumina der Komponenten getrennt zu entnehmen und diese zu mischen. Um beispielsweise eine 70%ige organische mobile Phase zu erhalten, sollten 300 ml Wasser und 700 ml organisches Lösungsmittel separat genau abgemessen und dann in einem Kolben zusammengeführt werden. Wird jedoch nur das Wasser genau abgemessen und dann das organische Lösungsmittel hinzugefügt, um das erforderliche Endvolumen zu erreichen, so wird die resultierende Lösungsmittelstärke aufgrund der Kontraktion des Lösungsmittelgemischs etwas höher sein (oder schwächer, wenn das organische Lösungsmittel zuerst und das Wasser später hinzugefügt wurde). Bei der Vormischung von MP ist auf die möglicherweise austretenden giftigen Lösungsmitteldämpfe zu achten. Sie muss unter einem Abzug geschehen.
Heute werden Gradienten in der Regel mit Gradientenpumpen korrekt formuliert, allerdings lassen sich beim Vergleich der Instrumente mit Nieder- und Hochdruckgradientensystemen aufgrund ihrer Mischmechanismen einige geringfügige Unterschiede im Retentionsverhalten beobachten. Bout-Ansätze haben Vor- und Nachteile: Instrumente mit Niederdruck-Gradientenformung sind einfacher und daher wartungsärmer. Der Hauptvorteil aber ist ein konstanter Fluss, der vom Gradienten unabhängig ist. Der Durchfluss, der durch Systeme mit Hochdruck-Gradientenformung erhalten wird, ist aufgrund der Kontraktion des Lösungsmittels nach dem Mischen um einige Prozent niedriger als eingestellt. Das ist zu erwägen, wenn man eine etablierte Methode von einem Gerätetyp auf einen anderen transferiert.
In der Umkehrphasen-Chromatographie ist es meist besser, mit vorgemischten mobilen Phasen wie 5 % Acetonitril in Wasser und/oder 5 % Wasser in Acetonitril zu arbeiten. Das Ziel ist eine erhöhte Entgasungseffektivität, das Vermeiden einer Erwärmung des Gemisches (z. B. Methanol in Wasser) oder der Abkühlung (z. B. Acetonitril in Wasser) nach dem Mischen und die verbesserte Mischeffizienz, da die zwei mobilen Phasen in Bezug auf Viskosität und Oberflächenspannung einander ähnlicher werden. Die Einschränkungen solcher vorgemischten Lösungsmittel liegen darin, dass es nicht möglich ist, die Lösungsmittelstärke der mobilen Phase B zu 100 % zu erreichen, und dass ein zusätzlicher Schritt bei der Vorbereitung der mobilen Phase erforderlich ist – was eine weitere mögliche Fehlerquelle darstellt. Meist wird empfohlen, die Lösungsmittel der mobilen Phase unmittelbar aus ihren Lieferbehältern zu verwenden, um zusätzliche Kontaminationsgefahren zu vermeiden.
Bei der Analyse von Proben, die ionisierbare Verbindungen enthalten, kann der Puffer eine der wichtigsten Variablen zur Retentionskontrolle bei einer HPLC-Trennung sein. Der pH-Wert der mobilen Phase bestimmt das Vorhandensein von ionisierbaren Verbindungen (Analyten und Matrix) in ionisiertem oder nicht-ionisiertem Zustand. Bei der Umkehrphasen-Chromatographie (RP) eluieren die ionisierten Spezies immer früher von der Säule als die nicht-ionisierten Spezies. Eine Änderung des pH-Werts kann auch die Selektivität für eine effektive Trennung von eng eluierenden oder sich überlappenden Peaks erhöhen. Eine Variabilität im pH-Wert zwischen Läufen führt zu einer inkonsistenten Trennung. Puffer verhindern pH-Schwankungen. Daher ist die richtige Wahl des Puffers in Bezug auf Pufferspezies, Ionenstärke und pH-Wert der wichtigste Schritt bei der Entwicklung einer HPLC-Methode, wenn ionisierbare Substanzen analysiert werden.
Tipps für die Wahl des LC-Puffers
Wahl des Puffers. Die Wahl des richtigen Puffers für eine Anwendung wird durch Puffereigenschaften wie pKa, pH-Bereich und UV-Cut-off bestimmt. In der Regel sollten die Puffer bei einem pH-Wert innerhalb von +/-1 Einheit ihres pKa-Werts verwendet werden. Innerhalb dieses Bereichs widerstehen die Puffer allen absichtlichen Versuchen, den pH-Wert zu verändern. Die Kapazität des Puffers ist am größten, wenn sein pH-Wert gleich seinem pKa-Wert ist. Auch der UV-Cut-off-Wert muss berücksichtigt werden, da die Nachweiswellenlänge nicht mit der Extinktion des Puffers interferieren sollte (signifikante Extinktion: Trifluoressigsäure <220 nm; Ameisensäure, Essigsäure <240 nm). Für beste Ergebnisse mit einem ionisierbaren Analyten von Interesse sollte ein Puffer mit einem pH-Wert verwendet werden, der mindestens 2 Einheiten vom pKa-Wert entfernt ist. Liegt der pH-Wert der mobilen Phase zu nahe am pKa-Wert des Analyten, werden möglicherweise Split-Peaks oder Schultern beobachtet, da beide Spezies in der Probe vorhanden sind. Bei mehreren ionisierbaren Analyten von Interesse sollte vorzugsweise ein pH-Wert gewählt werden, bei dem alle Analyten in der gleichen Form vorliegen, entweder ionisiert oder nicht-ionisiert.
- pH-Wert des Puffers messen. Der pH-Wert des Puffers ist der pH-Wert des wässrigen Anteils vor der Zugabe der organischen mobilen Phase. Durch die Zugabe eines organischen Lösungsmittels verschiebt sich der pH-Wert normalerweise entweder nach oben oder nach unten (die pH-Verschiebung sollte für denselben Puffer konsistent sein). Es ist nicht so wichtig, den genauen pH-Wert des Puffers in einem organischen Medium zu kennen. Jedoch ist es wichtig, einen konsistenten pH-Wert zu haben (da der pKa-Wert Ihrer Analyten auch in der wässrigen Phase bestimmt wird und die einzelnen pKa-Verschiebungen ebenfalls unbekannt sind).
- Chemische Reinheit. Die Qualität/Reinheit der Zusatzstoffe der mobilen Phase (Puffer, Salze, Säuren und Basen) sowie die in einem HPLC-Experiment verwendeten organischen Lösungsmittel müssen an die Empfindlichkeit des Detektors und das Elutionsprotokoll angepasst werden.
- Chemische Kompatibilität. Die Zusammensetzung des Puffers muss zusammen mit dem pH-Wert der mobilen Phase in Übereinstimmung mit dem Material des Säulengehäuses und der Beschaffenheit der stationären Phase gewählt werden, um die Korrosion des einen oder anderen zu verhindern.
- MS-Kompatibilität. Es wird davon abgeraten, Mineralsalze in ein Massenspektrometriesystem einzuführen. Beispiele für geeignete flüchtige Puffer sind Ammoniumacetat, Ammoniumformiat und Ammoniumcitrat. pH-Modifikatoren wie Ameisensäure und Essigsäure sollten zur Kontrolle des pH-Werts und zur Unterstützung der Ionisierung für LC-MS verwendet werden.
- Pufferlöslichkeit. Im Idealfall sollte der Puffer vollständig wasserlöslich sein (RP-Methoden) und während der Analyse nicht ausfällen, wenn er mit dem gewählten organischen Lösungsmittel gemischt wird. Die Pufferkonzentration muss daher sorgfältig gewählt werden, um eine Ausfällung bei höheren Konzentrationen im organischen Lösungsmittel zu vermeiden. Wird dies vernachlässigt, kann es zu Funktionsproblemen mit den Pumpen kommen und zu einer Blockierung der HPLC-Säule oder einem Rückdruckanstieg führen.
- Pufferstärke. Ein Eluent, der eine schwache Wechselwirkung mit der stationären Phase zeigt, ist nur in der Lage, schwach gebundene Analyten von der Säule zu eluieren, wohingegen eine starke Wechselwirkung die Elution stark gebundener Probenmoleküle bewirkt. Die Elutions- oder Lösungsmittelstärke verschiedener Lösungsmittel hängt von der Art der verwendeten stationären Phase ab. Nach der Elutionsstärke spielt die Viskosität des Puffers eine wichtige Rolle, was seine Eignung für die HPLC-Analyse betrifft.
- Pufferkonzentration. Idealerweise sollte die niedrigste Konzentration gewählt werden, mit der sich reproduzierbare Ergebnisse erreichen lassen. Höhere Konzentrationen führen zu einer schnelleren Elution von polaren Molekülen. Im Allgemeinen sollte die Pufferkonzentration nicht niedriger als 5 mM sein. Unterhalb dieser Konzentration agiert er möglicherweise nicht mehr als Puffer (abhängig von der Analytkonzentration und der Pufferkapazität). Eine Erhöhung der Pufferkonzentration kann die Viskosität erhöhen, was wiederum den Rückdruck der Säule erhöhen kann. In der Regel sollte die Konzentration im Bereich von 5 bis 100 mM gehalten werden. Bei einer Konzentration von mehr als 100 mM an Mineralsalzpuffern verschleißen die beweglichen Teile der Pumpe schneller, weshalb der Einbau einer Hinterspülung empfohlen wird.
Es ist zu beobachten, dass Puffer bei den meisten HPLC-Trennungen eine entscheidende Rolle spielen. Methodenentwicklungen erfordern oft eine sorgfältige Wahl der Puffer und angemessene Sorgfalt bei ihrer Zubereitung. Daher sollten folgende allgemeine Regeln beachtet werden: Pufferlösungen müssen homogen, klar und frei von jeglichen Partikeln sein. Hinsichtlich der Aufbewahrung ist zu beachten, dass Puffer eine begrenzte Haltbarkeit haben. Daher sollte man erwägen, sie täglich für den jeweiligen Bedarf zuzubereiten.
ISOLIERUNG VON PUMPENPROBLEMEN
Die Pumpe muss unter verschiedensten Bedingungen einen konstanten Lösungsmittelfluss zur Säule liefern. HPLC-Pumpen sind als Einzel- oder Doppelkolben-, Spritzen- oder Membranpumpen konzipiert. Es können Niederdruck- oder Hochdruck-Gradientensysteme sein (Abbildung 2 und 3). Beide Ansätze werden angewendet, jedoch kann die Hochdruck-Gradientenpumpe aufgrund der Lösungsmittelkontraktion nach dem Mischen eine bis zu 4 % niedrigere Flussrate liefern als den eingestellten Wert, was die Präzision der chromatographischen Trennungen beeinträchtigen könnte. Andererseits verzögert die Niederdruck-Gradientenpumpe das Eintreffen des Gradienten an der Säule, was die Aufrechterhaltung präziser Elutionsbedingungen erschwert. Dies stellt besonders beim Gebrauch von steilen Gradienten mit hoher Geschwindigkeit ein Problem dar. Diese Betriebseigenschaften sollten bei der Wahl eines Pumpensystems je nach den spezifischen Anforderungen der chromatographischen Analyse sorgfältig erwogen werden und werden besonders relevant, wo die Methode von einem Gerät auf ein anderes übertragen wird.
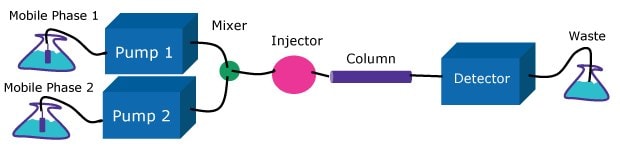
Figure 2High-pressure gradient system
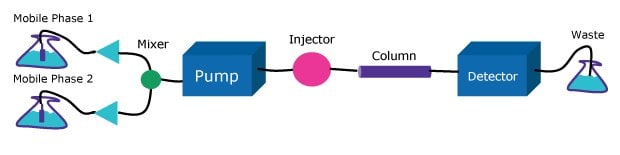
Figure 3.Low-pressure gradient system
Zu den Problemen mit Chromatographiepumpen (Tabelle 4 ) können verschiedene Probleme gehören, die die Leistung und Zuverlässigkeit der Pumpe in der Chromatographie beeinträchtigen können.
Um solche Probleme zu vermeiden, erfordert es häufig einer routinemäßigen Wartung und Überprüfung und des Austauschs von Verbrauchsmaterialien. Zudem müssen die ordnungsgemäße Kalibrierung und der sachgemäße Betrieb der Chromatographiepumpe sichergestellt sein. Regelmäßige Systemprüfungen und die Einhaltung der empfohlenen Wartungspläne sind für eine optimale Chromatographieleistung unerlässlich.
Probleme mit dem Pumpensystem sind in der Regel leicht zu erkennen und zu beheben. Ein typisches Problem von Pumpensystemen ist ein wiederholtes Basislinienrauschen, dessen Häufigkeit proportional zur Durchflussmenge zunimmt. Ein sicheres Anzeichen für eine Leckage ist eine Ansammlung von Salzen an einem Pumpenanschluss. Die Puffersalze sollten täglich mit frischem, entionisiertem Wasser aus dem System gespült werden. Für die Eingrenzung und Behebung spezifischer Probleme an Ihrem Gerät ziehen Sie die Abschnitte zur Problembehandlung und Wartung im Bedienerhandbuch zu Rate oder wenden Sie sich an Ihren Gerätevertreiber. Pumpendichtungen müssen regelmäßig ausgetauscht werden. Beim Kauf eines neuen (U)HPLC-Systems wird ein vorbeugendes Wartungsprogramm dringend empfohlen.
INJEKTOR UND INJEKTIONSLÖSUNGSMITTEL
Mit dem Injektor wird die Probe schnell und mit minimaler Unterbrechung des Lösungsmittelflusses in das System eingeleitet. In HPLC-Systemen werden derzeit Injektoren mit variabler Schleife, mit fester Schleife und mit Spritzen verwendet. Diese Vorrichtungen werden manuell, pneumatisch oder elektrisch aktiviert.
Mechanische Probleme mit dem Injektor (z. B. Undichtigkeiten, verstopfte Kapillarschläuche, verschlissene Dichtungen) sind leicht zu erkennen, und zu ihrer Behebung müssen verschiedene Probleme angegangen werden, die Auswirkungen auf die Qualität und Reproduzierbarkeit der Chromatographie-Ergebnisse haben können. Benutzen Sie einen Vorsäulenfilter, um ein Verstopfen der Säulenfritte aufgrund der physischen Degradation der Injektordichtung zu verhindern. Andere Probleme, wie nicht reproduzierbare Injektionen, sind schwieriger zu beheben.
Unterschiedliche Peakhöhen, Split-Peaks und breite Peaks können durch unvollständig gefüllte Probenschleifen, Unverträglichkeit des Injektionslösungsmittels mit der mobilen Phase oder schlechte Löslichkeit der Probe verursacht werden. Wann immer möglich, sollten die Proben in der mobilen Phase gelöst und injiziert werden, die zum Zeitpunkt der Injektion durch die Säule fließt. Andernfalls ist darauf zu achten, dass das Injektionslösungsmittel eine geringere eluotrope Stärke als die mobile Phase aufweist (Tabelle 3). Bitte beachten Sie, dass in einigen Autosamplern separate Spritzenwaschlösungen eingesetzt werden. Achten Sie darauf, dass die Waschlösung mit der mobilen Phase kompatibel und schwächer als diese ist. Diese Tatsache ist besonders wichtig, wenn zwischen Umkehr- und Normalphasen- oder Hydrophilic Interaction Liquid Chromatography (HILIC)-Analysen gewechselt wird. Die Sauberkeit der äußeren Oberfläche der Injektionsnadel ist ebenfalls entscheidend, insbesondere bei hochkonzentrierten oder viskosen Proben. Es wird empfohlen, die Nadel von außen zu waschen, um Rückstände von früheren Injektionen und eine Kontamination der Injektionsnadel zu vermeiden, die die Genauigkeit der nachfolgenden Analysen beeinträchtigen und Kreuzkontaminationen zwischen verschiedenen Proben verursachen könnte. Dies kann durch Eintauchen der Nadel in ein oder mehrere Fläschchen erreicht werden, die Waschlösungen zur gründlichen Reinigung der Außenseite der Nadel enthalten. Eine ordnungsgemäße Außenreinigung trägt nicht nur dazu bei, die Integrität des Chromatographiesystems aufrechtzuerhalten, sondern letztlich auch zur Präzision und Zuverlässigkeit der Analyseergebnisse.
Eine ordnungsgemäße Probenvorbereitung ist unabdingbar, um die Genauigkeit und Zuverlässigkeit der chromatographischen Analysen zu gewährleisten. Vor der Injektion müssen die Proben unbedingt gefiltert werden, um mögliche Verstopfungen der Injektionsnadel sowie Probleme im nachgelagerten System zu vermeiden. Bei der Filterung werden Partikel entfernt, die die engen Kanäle der Injektionsnadel verstopfen könnten, wodurch ein reibungsloses und konsistentes Injektionsverfahren gewährleistet wird. Außerdem ist es ratsam, bei der Entnahme von Proben aus den Fläschchen die Aufnahme ganz unten vom Fläschchenboden zu vermeiden, da sich dort mit der Zeit Sedimente bilden können. Die Sedimentation kann dazu führen, dass unerwünschte Partikel in das Chromatographiesystem gelangen und die Säule verstopfen oder verschmutzen. Durch bewährte Praktiken wie das Filtrieren von Proben und die Vermeidung von Injektionen vom Flaschenboden können Analytiker die allgemeine Zuverlässigkeit und Präzision der Chromatographie-Ergebnisse erhöhen, das Risiko von Systemkontaminationen minimieren und für eine optimale Leistung sorgen.
SÄULENSCHUTZ
Obwohl sie nicht fester Bestandteil der meisten Geräte sind, verringern Einlassfilter für die mobile Phase, Vorinjektor- und Vorsäulenfilter und Vorsäulen die mit komplexen Trennungen verbundenen Probleme erheblich. Wir empfehlen, alle Proben durch 0,45 μm- oder 0,2 μm-Spritzenvorsatzfilter zu filtern.
Inline-Filter spielen eine zentrale Rolle in Chromatographiesystemen und dienen als unverzichtbare Komponenten zur Verbesserung der Qualität und Langlebigkeit der Analysesäulen. Strategisch im Flüssigkeitsweg angeordnet, fangen diese Filter Partikel, Ablagerungen oder Verunreinigungen in der mobilen Phase oder der Probe ab, bevor sie die Chromatographiesäule erreichen. Indem sie das Eindringen unerwünschter Partikel verhindern, tragen Inline-Filter zum Schutz und zur Erhaltung des Packmaterials der Säule bei, verlängern so deren Lebensdauer und gewährleisten konsistente und reproduzierbare Trennungen. Inline-Filter sind nicht als Ersatz für die Filtration gedacht, sondern vielmehr als zusätzlicher Schutz für die Säule. Die Porosität der Inline-Filter sollte kleiner sein als die der Säuleneinlassfritten. Wenn zum Beispiel die Fritte am Kopf der Säule, die mit 5-µm-Partikeln gefüllt ist, 2 µm aufweist, sollte die Porosität des Inline-Filters ca. 1-0,5 µm betragen. Wenn der Rückdruck des Systems zu steigen beginnt, ist der Inline-Filter zu überprüfen und gegebenenfalls zu ersetzen.
In allen Fällen empfehlen wir dringend den Gebrauch von Schutzsäulen. Die stationäre Phase in der Schutzsäule sollte auf die analytische Säule abgestimmt sein, sodass sie Substanzen abfängt, die irreversibel an der Analysesäule adsorbiert würden, was deren Lebensdauer einschränken würde. Die Schutzsäule fungiert als Opferelement im Chromatographiesystem. Die Nutzungsdauer dieser Einwegprodukte hängt u.a. von der Zusammensetzung der mobilen Phase, dem Injektionsvolumen, der Reinheit der Probe und dem pH-Wert ab. Wenn diese Produkte verunreinigt oder mit Partikeln verstopft werden, erhöht sich der Druck, und die Peaks verbreitern oder teilen sich.
DAS BESTE AUS IHRER ANALYSESÄULE HERAUSHOLEN
Unabhängig davon, ob die Säule für gebundene Umkehr- oder Normalphase, Ionenaustausch, Affinität, hydrophobe Wechselwirkung, Größenausschluss oder auf Harz-/Silicabasis gepackt ist, ist das häufigste Problem im Zusammenhang mit Analysesäulen ihre altersbedingte Verschlechterung. Anzeichen für eine Abnutzung sind eine schlechte Peakform, Split-Peaks, Schultern, Auflösungsverlust, verkürzte Retentionszeiten und hoher Rückdruck. Diese Symptome deuten darauf hin, dass sich Verunreinigungen auf der Fritte oder dem Säuleneinlass angesammelt haben, oder dass Hohlräume, Kanäle oder eine Vertiefung im Packungsbett vorhanden sind.
Bei Säulen mit höherem Wirkungsgrad kommt die Verschlechterung deutlicher zum Tragen. So ist beispielsweise eine 3,0-µm-Packung, die von 0,5-µm-Fritten zurückgehalten wird, anfälliger für Verstopfungen als eine 5- oder 10-µm-Packung, die von 2,0-µm- oder größeren Fritten zurückgehalten wird. Der richtige Schutz der Säule und die richtige Probenvorbereitung sind entscheidend für die optimale Nutzung jeder Säule.
Die Überladung einer Säule kann zu schlechten Peakformen und weiteren Problemen führen.
TYPISCHE SÄULENKAPAZITÄT
Die Säulenkapazität hängt von vielen Faktoren ab. Typische Werte für das maximale Gesamtinjektionsvolumen und die Probenmengen der Analyten an einer Säule sind in Tabelle 5 aufgeführt. Das maximale Injektionsvolumen sollte nicht mehr als 2 % des gesamten Säulenvolumens betragen, und die typische Probenkonzentration in der HPLC liegt bei etwa 1 mg/ml. Beachten Sie, dass Effizienz und Auflösung in der Regel mit abnehmendem Injektionsvolumen zunehmen.
LÖSUNG VON DETEKTORPROBLEMEN
Detektorprobleme lassen sich in zwei Kategorien einteilen – elektrische und mechanisch/optische Probleme. Bei elektrischen Problemen wenden Sie sich bitte an den Hersteller des Geräts. Mechanische oder optische Probleme können in der Regel auf die Durchflusszelle zurückgeführt werden. Probleme mit Detektoren können Zellkontamination, Luftblasen und Lecks sein. Diese führen in der Regel zu geringerer Empfindlichkeit, Drifts, Basislinienrauschen oder Spitzen im Chromatogramm. Bestimmte Zellen sind druckempfindlich, insbesondere solche, die in Brechungsindexdetektoren zu finden sind. Durchflussraten oder Rückdrücke, welche die Empfehlungen des Herstellers überschreiten, führen zum Bruch des Zellfensters. Durch alte oder defekte Lampen sowie eine falsche Anstiegszeit, Verstärkung oder Dämpfung des Detektors wird die Empfindlichkeit und Peak-Höhe verringert.
GENAUE AUFZEICHNUNGEN FÜHREN
Die meisten Probleme treten nicht plötzlich auf, sondern entwickeln sich schleichend. Genaue Aufzeichnungen sind für die Erkennung und Behebung vieler Probleme unerlässlich.
Bewerten Sie jede eingehende Säule beim Empfang und danach in regelmäßigen Abständen. Wenn Sie die Säuleneffizienz, die verwendeten mobilen Phasen, den Lampenstrom, die Pumpenleistung usw. schriftlich festhalten, kann die Systemleistung damit überwacht werden.
Aufzeichnungen helfen auch, Fehler zu vermeiden, wie z. B. das Einbringen von Wasser in eine Kieselgelsäule oder das Ausfällen von Puffer im System durch Zugabe von zu viel organischem Lösungsmittel. Viele Analytiker modifizieren ihre HPLC-Systeme in irgendeiner Weise. Zuverlässige Aufzeichnungen sind der beste Weg, um sicherzustellen, dass eine Modifikation nicht zu Problemen führt. Bei Problemen mit Pumpen, Detektoren, automatischen Probennehmern und Datensystemen lesen Sie bitte die Anleitung zur Fehlerbehebung im Handbuch Ihres Geräts oder wenden Sie sich an Ihren Servicetechniker für das Gerät.
HPLC-PROBLEME, URSACHEN UND ABHILFEMASSNAHMEN
Kleine Unterschiede in der Zusammensetzung der mobilen Phase können zu großen Unterschieden in der Retentionszeit führen, wenn die Säule überladen wird. Dies ändert sich auch mit der Temperatur. Doch selbst wenn die mobile Phase gepuffert ist und die Pumpe ordnungsgemäß funktioniert, können die Retentionszeiten schwanken, wenn der pH-Wert zu nahe am pK-Wert der Probensubstanz liegt. Der pH-Wert der mobilen Phase sollte daher so gewählt werden, dass er mindestens eine pH-Einheit über oder unter dem pK-Wert der zu trennenden Analyten liegt. Ein Retentionszeit-Drift deutet auf eine unzureichende Säulenkonditionierung hin. Mit zunehmender Säulenlebensdauer können sich die Retentionszeiten in Richtung eines geringeren Retentionsvermögens verschieben, insbesondere wenn bei sauren pH-Werten (≤pH 2) gearbeitet wird. Abrupte Änderungen der Retentionszeit sind in der Regel auf Fehler im System zurückzuführen.
Das Problem: Sich ändernde Retentionszeiten

Figure 3.Variable Retention Times. A) Normal, B) Problem, C) Problem
Das Problem: Abnehmende Retentionszeiten
Das Problem: Längere Retentionszeiten
Das Problem: Langsame Säulen-Äquilibrierzeit
Das Problem: Variierende Retentionszeiten
Peaks
Wenn alle Peaks im Chromatogramm das gleiche Erscheinungsbild aufweisen, ist das Problem vor der Trennung aufgetreten. Wenn nur einige der Peaks oder nur ein Peak im Chromatogramm verzerrt eluieren, ist die Ursache chemischer Natur.
Das Problem: Breite Peaks
Breite Peaks entstehen entweder durch erheblichen Einfluss des HPLC-Systems (schlechte Kapillarverbindungen, Leervolumen, zu große Detektorzellen oder unpassend gewählte Zeitkonstanten) oder durch eine schlechte Säulenleistung.

Figure 4.Typical chromatograms, A). Normal peaks B) Broad peaks
Das Problem: Geisterpeaks
Geisterpeaks können durch unbekannte Probenkomponenten, späte Elutionsspitzen aus früheren Injektionen, Verunreinigungen oder Mischungsprobleme in Verbindung mit der mobilen Phase verursacht werden. Die Probe sollte daher vorzugsweise immer im Eluent oder in einem Lösungsmittel mit schwächerer Elutionsstärke gelöst werden. Substanzen mit einer geringeren UV-Absorption als der Eluent können negative Peaks erzeugen.
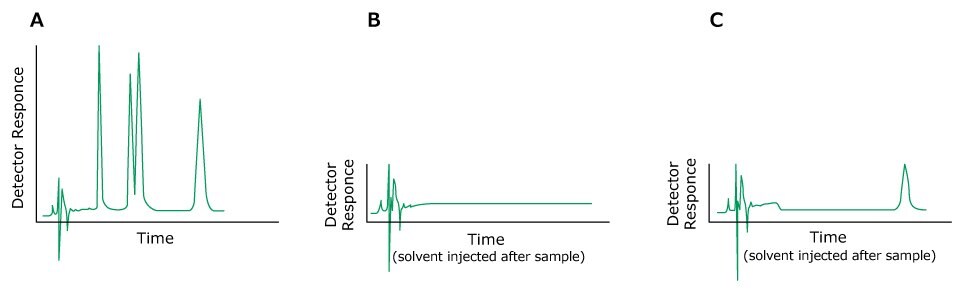
Figure 5.HPLC chromatograms, A) Previous sample, B) After injection of solvent following the solvent with no ghost peak, C) After injection of solvent following the solvent showing a ghost peak
Das Problem: Negative Peaks

Figure 6.A) Normal chromatogram, B) Chromatogram with negative peaks
Das Problem: Peak-Verdopplung
Wenn alle Peaks Schultern haben oder als doppelte Peaks eluieren, kann dies an verstopften Inline-Filtern, Fritten am Säuleneinlass, kontaminierten Vorsäulen oder einem Totvolumen am Säulenkopf liegen. In den meisten Fällen kann die Säule durch Reinigen oder Austauschen der Einlassfritte in ihren ursprünglichen Zustand zurückgesetzt werden. Eine kurzfristige Lösung für dieses Problem könnte auch darin bestehen, die Säule umzukehren. Zerstörtes Bett am Säulenauslass trägt nur geringfügig zur Peakverbreiterung bei.
Das Problem: Peak-Fronting
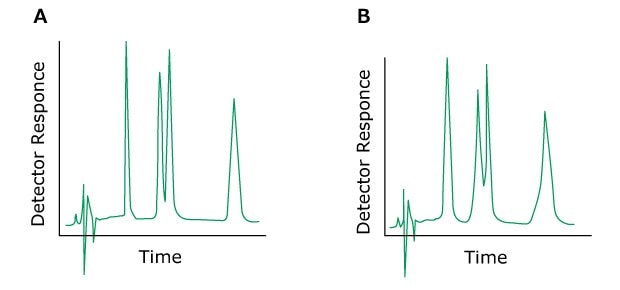
Figure 7.Typical chromatograms, A) normal without a fronting peak B) with a fronting peak
Das Problem: Peaktailing
Die Überlagerung von Peaks, die früh eluieren, wird durch zusätzliche Säuleneffekte verursacht. Um Abhilfe zu schaffen, sollte das gesamte System überprüft werden – Kapillaranschlüsse, Schläuche und Detektorzelle. Sekundäre, unspezifische Interaktionen mit der Silicaoberfläche führen zum Tailing später Elutionsspitzen und sogar zum Auftreten doppelter Peaks. Die Zugabe von Triethylamin oder Acetat zur mobilen Phase oder die Auswahl einer geeigneten stationären Phase verbessern die Peakform erheblich. Ein falsch gewählter pH-Wert für die mobile Phase kann ebenfalls zu Peaktailing führen. Grundsätzlich sollte die Chromatographie eine pH-Einheit über oder unter den pK-Werten der Probensubstanzen durchgeführt werden.
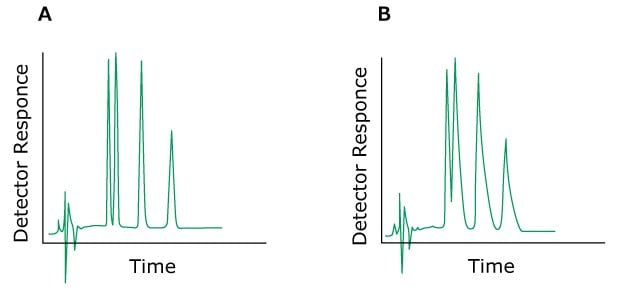
Figure 8.Typical chromatograms, A) Normal without a tailing peak B). With a tailing peak
Das Problem: Spikes
Das Problem: Keine Peaks
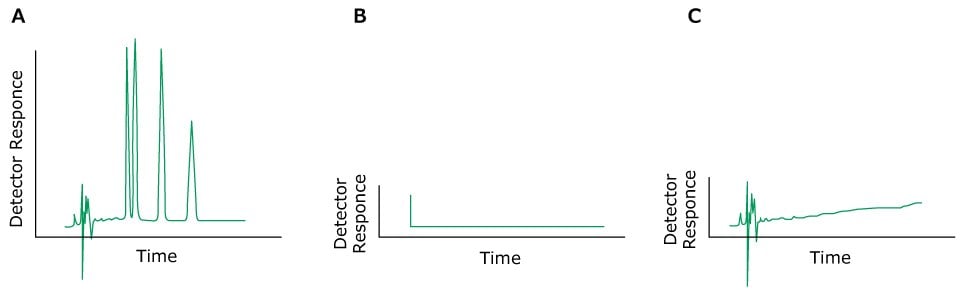
Figure 9.Typical chromatograms, A) Normal peaks, B) No peaks, C) Very small peaks
Das Problem: Peaks mit Schultern, Split-Peaks
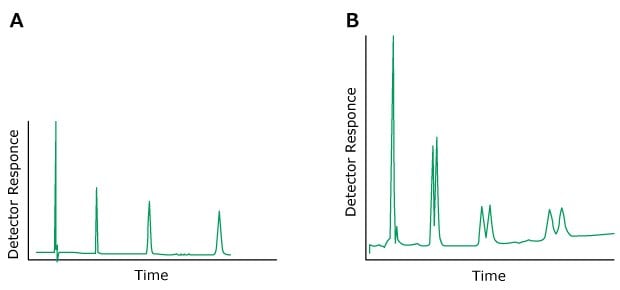
Figure 10.Typical chromatograms A) Normal peaks B) Split peaks
Das Problem: Veränderung der Peakhöhe (ein oder mehrere Peaks)
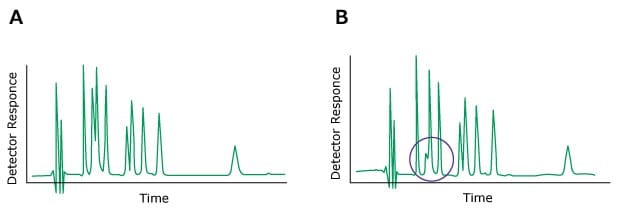
Figure 11.Typical chromatograms, A) Normal B) One peak with a different height
Das Problem: Verlust der Auflösung
Das Problem: Abgerundete Peaks
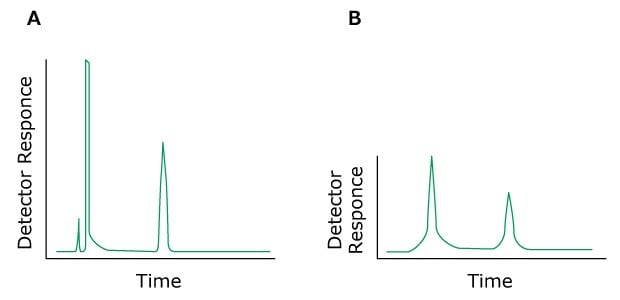
Figure 12.Typical chromatograms, A) Normal, B) Rounded Peaks
Das Problem: Leck an Säule oder Anschlussstücken
Das Problem: Leck am Detektor
Das Problem: Leck am Injektionsventil
Das Problem: Leck an Pumpe
Das Problem: Unterschiede in der Selektivität

Figure 13.Typical chromatograms, A) Normal, B) Problem of change in selectivity
Das Problem: Störung in der Leerlaufphase
Das Problem: Driftende Basislinie
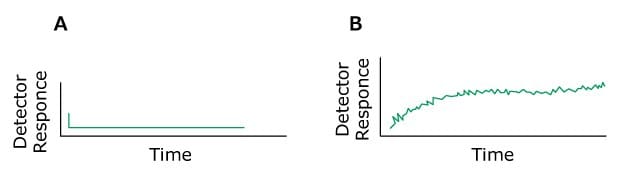
Figure 14.Typical chromatograms, A) Normal B) Baseline Drift
Das Problem: Rauschen
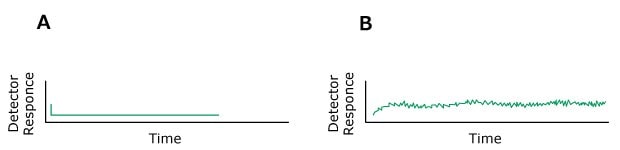
Figure 14.Typical chromatograms, A) Normal, B) Baseline noise (regular)
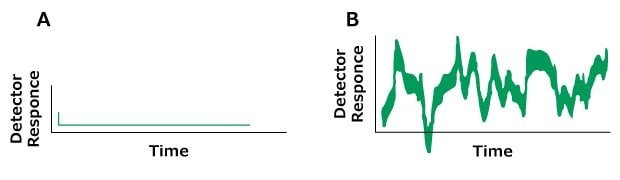
Figure 15.Typical chromatograms, A) Normal B) Problem (Irregular baseline noise)
Ein Druckproblem ist in der Regel mit einem zu hohen Gegendruck verbunden. Um herauszufinden, wo das Problem liegt, ist es gute Laborpraxis, das System beginnend mit der Pumpe schrittweise zu trennen und sich in Richtung Detektor vorzuarbeiten.
Das Problem: Druckabfall
Das Problem: Schwankender Druck
Das Problem: Hoher Gegendruck
Das Problem: Kein Durchfluss
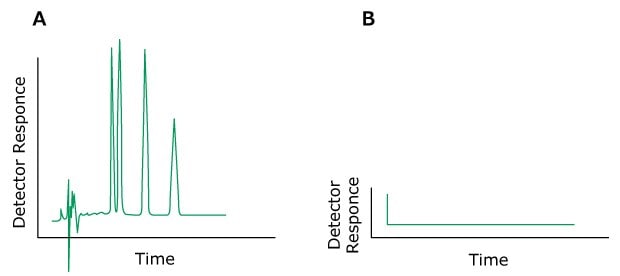
Figure 16.Typical chromatograms A) Normal, B) Problem (No flow)
Weitere Empfehlungen
Wir empfehlen auch, die Abschnitte zur Wartung und Problembehandlung im Gerätehandbuch zu lesen oder sich an einen Wartungstechniker zu wenden. Moderne HPLC-Systeme verfügen häufig über Selbstdiagnosefunktionen, die helfen, den Problembereich innerhalb des Geräts zu isolieren. Bei anhaltenden Problemen mit der Säule oder Ihrer Analyse wenden Sie sich bitte an die technische Wartungsabteilung von Supelco.
Die übrigen Seiten dieses Leitfadens umfassen Verfahren zur Wiederherstellung der Säulenleistung nach einem Verlust an Auflösung, Retention oder Selektivität; Vorschläge zur Vorbeugung und Lösung von Hardware-Problemen mit Säulen sowie eine Auswahl von Säulenschutzprodukten aus dem Supelco-Portfolio. Auf unserer Website finden Sie eine komplette Reihe von Zubehörteilen, die die Lebensdauer der Säule verlängern und generell Ihre (U)HPLC- oder FPLC®-Analyse vereinfachen oder verbessern
WIEDERHERSTELLUNG DER LEISTUNG IHRER SÄULE
Die Exposition einer Säule gegenüber Proben oder Lösungsmitteln, die stark adsorbierende Komponenten enthalten, führt zu einem erhöhten Gegendruck und einer Änderung der Selektivität. Oft kann die ursprüngliche Leistung der Säule durch geeignete Waschprotokolle wiederhergestellt werden. Bei der Regeneration durch Lösungsmittelspülung sollte die Säule umgekehrt und vom analytischen HPLC-System auf eine einfache, kostengünstige Pumpe umgestellt werden. Alternativ können Sie die Säule vom Detektor trennen und eine Spülung direkt in den Abfluss durchführen. Jedes Lösungsmittel sollte mit mindestens 20, vorzugsweise 30, Säulenvolumen gespült werden.
Es ist wichtig, dass Sie zuerst die Bedienungsanleitung, die jeder Säule beiliegt, sehr sorgfältig lesen. Dieses Blatt enthält auch Informationen zu empfohlenen Maßnahmen zur Säulenpflege und -regeneration. Diese Anweisungen müssen befolgt werden. Verunreinigungen der Säule an der Oberseite durch Partikel sollten im Allgemeinen leicht zu entfernen sein durch Waschen der Säule für etwa 5 bis 20 Säulenvolumen im Rückspülmodus, jedoch nur, wenn die Säulenbauart dies zulässt – wichtig ist, dass beide Säulenfritten (Ein- und Auslass) die gleiche Porosität aufweisen. Bitte beachten, dass es sehr unwahrscheinlich ist, dass kleine Partikel, die tiefer in der Säulenpackung eingeschlossen sind, entfernt werden. Als Folge eines solchen Waschvorgangs sollte der Säulengegendruck etwas geringer sein. Unspezifisch gebundenes Material aus der Säule zu entfernen, ist schwierig, und das Ergebnis ist in der Regel unvorhersehbar, da wir normalerweise nicht wissen, um welche Verbindungen es sich bei den Kontaminationen handelt. Die Erfolgsquote kann zwischen 0 und 100 % liegen. Eine vollständige Wiederherstellung der Gleichmäßigkeit der Säulenpackung bei Säulen mit Partikeln von weniger als 5 µm ist sehr unwahrscheinlich. Normalerweise hilft die Rückspülung von Säulen nur kurzfristig.
Wenn Sie sich für die Spülung/Regenerierung Ihrer Säule entschieden haben, sollten die folgenden schrittweisen Verfahren theoretisch eine Säule regenerieren, deren Leistung sich aufgrund einer Probenkontamination verschlechtert hat.
Hinweis: Alle Lösungsmittel, die für die Säulenregeneration verwendet werden, müssen die gleiche analytische Qualität aufweisen, wie sie normalerweise bei dieser Säule zur täglichen Analyse verwendet wird.
- Säule abklemmen und umkehren.
- An die Pumpe anschließen, nicht an den Detektor.
- Das entsprechende Spülverfahren aus dieser Tabelle 2 befolgen und eine Durchflussrate einsetzen, die zu einem Säulenrückdruck von 1500-4500 psi führt, aber niemals über dem in der Bedienungsanleitung des Herstellers empfohlenen Maximaldruck liegt. Bei einer Supelco®-Säule mit dem Testgemisch und den auf dem Datenblatt angegebenen Bedingungen analysieren.
- Die Säule mit dem üblichen Lösungsmittel konditionieren
- Säule mit einer Testmischungsprobe testen Wirkungsgrad, Symmetrie und Kapazität sollen innerhalb von 10-15 % der Testblattwerte liegen. Wenn nicht, ersetzen Sie die Säule.
Hinweis: Die in Tabelle 2 aufgeführten Volumina beziehen sich auf 25 cm x 4,6 mm I.D. Säulen mit einem Säulenvolumen von 4,15 ml. Bei der Wiederherstellung einer Säule mit einem Innendurchmesser von 4,6 mm, die kürzer oder länger als 25 cm ist, werden alle Volumina in Tabelle 2 mit dem Verhältnis der Säulenlänge zu 25 multipliziert (z. B. bei einer Säule von 15 cm: 15/25 oder das 0,6-fache der Volumina in Tabelle 2). Bei der Wiederherstellung einer Säule mit einem anderen Innendurchmesser als 4,6 mm sind alle Volumina in Tabelle 2 mit dem Verhältnis des Quadrats des Innendurchmessers der Säule zu (4,6)2 zu multiplizieren (z. B. bei einer Säule mit einem Innendurchmesser von 3,2 mm): (3,2)2/(4,6)2 = 10,24/21,16 = 0,48 mal die Werte in Tabelle 2).
Nicht-gebundene Kieselgelsäulen, die einem polaren Lösungsmittel ausgesetzt sind
Durch Proben und mobile Phasen, die sehr stark polare Lösungsmittel wie Wasser oder Alkohole enthalten, können unbeschichtete Kieselgel-HPLC-Säulen deaktiviert werden. Dies kann die Leistung der Säule drastisch beeinflussen, insbesondere die Retention der gelösten Stoffe und die Selektivität. Selbst durch längeres Spülen der Säule mit einem nicht polaren Lösungsmittel wird die Leistung der Säule nur teilweise wieder hergestellt und es werden Chemikalien verschwendet. Eine Silica-Regenerationslösung (die Essigsäure, Dimethoxypropan und Methylenchlorid enthält) kann die Leistung der Silica-Säule schnell und kostengünstig wiederherstellen, indem das eingeschlossene polare Material entfernt wird. Die Lösung 10 Minuten bei einer Durchflussrate von 4 ml/Minute durch die betroffene Säule pumpen, danach 10 Minuten mit der mobilen Phase bei einer Durchflussrate von 2 ml/Minute spülen. Prüfen Sie die Leistung der Säule mit einer Testmischung zur Prüfung von Silica-Säulen. Die Leistung sollte praktisch die gleiche sein wie vor der Zugabe des polaren Lösungsmittels.
Aufbewahrung der Säule
Die Säule kann kurz-, mittel- oder langfristig aufbewahrt werden.
- Kurzfristige Aufbewahrung, d. h. über Nacht: Die mobile Phase, die in der letzten Analyse verwendet wurde, kann innerhalb der Säule verbleiben. Alternativ ist auch ein Durchlaufen der mobilen Phase bei sehr niedriger Durchflussrate möglich (insbesondere wenn die Pufferkonzentration in der mobilen Phase hoch ist, >50 mM). In diesem Fall kann die Säulenkonditionierung möglicherweise übersprungen werden, bevor die Analyse am nächsten Tag fortgesetzt wird. Diese Option wird besonders für Normalphasentrennungen empfohlen, bei denen eine Änderung der Zusammensetzung der mobilen Phase zu einer längeren Neu-Äquilibrierung führen kann. Wenn die Pufferkonzentration in der mobilen Phase jedoch sehr hoch ist (>0,5 M), kann die Lebensdauer der Pumpenteile (z. B. Injektor und Umschaltventile) von der Zeit des Kontakts mit hochkonzentriertem Puffer abhängen. Dasselbe gilt für die Säule, wenn der pH-Wert nahe an der Grenze der Säule liegt (für die meisten Säulen auf Silicabasis pH 2 bis pH 7). Einige Salze, wie insbesondere Chloridsalze, sind sehr korrosiv gegenüber Edelstahl und können die Säulenwand sowie die Fritten am Ein- und Auslass angreifen. In solchen Fällen sollte die Säule (und das gesamte System) zu einer weniger aggressiven mobilen Phase gespült werden. In diesem Fall wird empfohlen, die Säule mit einer wasserreichen mobilen Phase (~90 %) mit etwa 10 Säulenvolumen zu spülen (ungefähre Säulenvolumen für einige gängige Säulenabmessungen, siehe Tabelle 1).
Wenn Sie eine Säule vom Gerät trennen, müssen die Endstopfen fest angebracht werden, um zu verhindern, dass Lösungsmittel verdampft und die stationäre Phase austrocknet. Der schlimmste Fall ist eine unzureichend gewaschene Säule, die zuvor mit hochkonzentriertem Salz verwendet wurde und im Laufe der Zeit ausgetrocknet ist – es bilden sich Salzkristalle, und die Säule wird höchstwahrscheinlich irreversibel beschädigt. Einige Säulen können trocken aufbewahrt werden, andere nicht. Bitte die Richtlinien des Herstellers für die Säulenpflege beachten. Standard-HPLC-Säulen sollten bei Raumtemperatur und niemals in einem Kühlschrank oder Gefrierschrank aufbewahrt werden (Ausnahmen sind Proteinaffinitätssäulen oder Reaktorsäulen mit aktiven Enzymen). Die Empfehlungen in diesem Absatz gelten auch für die mittel- und langfristige Aufbewahrung von Säulen.
- Mittelfristige Aufbewahrung, d. h. für 2 Tage oder über das Wochenende: Die Säulen sollten gespült werden. Die Intensität oder das Volumen der Spülung hängt von der Pufferkonzentration ab, die während der Analyse verwendet wird. Es ist generell ratsam, zunächst Puffermittel mit ca. 10 Säulenvolumen der mobilen Phase mit 10 % organischem Lösungsmittel in Wasser von der Säule zu spülen. In diesem Fall ist das Waschen effektiv; außerdem würden wir Pufferausfällungen und mögliche Probleme mit der Säulenentfeuchtung vermeiden. Dann kann die Säule mit dem Gerät verbunden bleiben oder getrennt und mit Endstopfen verschlossen werden. Bitte berücksichtigen Sie auch Empfehlungen zur kurzfristigen Aufbewahrung von Säulen, z. B. den Verweis auf die Säulendokumentation für das empfohlene Lösungsmittel zur Aufbewahrung.
Bei der Aufbewahrung einer HILIC-Säule in einem Acetonitril-Wasser-Gemisch kann es lange dauern, bis die Re-Äquilibrierung wiederhergestellt ist, wenn für die Analysemethode ein Puffer mit niedriger Ionenstärke (z. B. 5-mM-Ammoniumacetat) verwendet wird. Daher wird für HILIC-Säulen empfohlen, diese in Lösungsmitteln mit 80–90 % Acetonitril und Puffern mit 5–10 mM Ammoniumacetat oder Ammoniumformiat aufzubewahren.
Ionenaustausch- und Mixed-Mode-Phasen, die funktionelle Carbonsäuregruppen enthalten (z. B. schwache Kationenaustauschphasen), können aufgrund der langsamen Veresterung und der daraus resultierenden Änderung der Selektivität/Kapazität nicht in alkoholhaltigen Lösungen aufbewahrt werden.
- Für die langfristige Aufbewahrung: Säulen auf Silicabasis sollten nach ordnungsgemäßer Reinigung mit mindestens 15 Säulenvolumen (Tabelle 1) an ca. 10 % organischem Lösungsmittel in Wasser für mindestens 10 Säulenvolumen mit organisch reicher mobiler Phase gespült werden und können in einem aprotischen Lösungsmittel aufbewahrt werden. Wenn auch Wasser vorhanden sein könnte, sollte es nicht in höheren Konzentrationen vorliegen, definitiv unter 50 %. Das beste in der Literatur empfohlene Lösungsmittel zur Aufbewahrung ist Acetonitril oder Methanol (es gibt einige Ausnahmen, z. B. Säulen mit Amidmodifikation; diese sollten nur in Acetonitril aufbewahrt werden). Einige Studien1 zeigen auch, dass die Erosions- und Korrosionsraten der Edelstahlkomponenten bei der HPLC unter Verwendung von reinem Acetonitril oder Methanol unter RP-Bedingungen höher waren als bei Mischung mit Wasser. Daher ist 90 % Acetonitril oder Methanol ein perfektes Langzeit-Aufbewahrungsmedium für die meisten Umkehrphasensäulen. Für Umkehrphasensäulen ist die bevorzugte Aufbewahrungslösung eine Mischung aus Isopropanol und Wasser (80/20), da Isopropanol eine höhere Viskosität und höheren Dampfdruck aufweist und die Wahrscheinlichkeit für ein Austrocknen der Säule verringert wird, auch wenn die Endstücke nicht vollständig abgedichtet sind. Isopropanol ist auch ein stärkeres Eluent, daher können wir nach der Aufbewahrung in Isopropanol sicher sein, dass noch mehr Verunreinigungen ausgewaschen werden als bei Acetonitril- oder Methanolgradienten. Nicht zuletzt ist Isopropanol auch weniger toxisch. Bitte beachten Sie, dass alle mobilen Phasen, die zum Spülen, Waschen oder Lagern der Säule verwendet werden, dieselbe Qualitätsstufe aufweisen müssen wie die für die Analyse verwendeten. Die Säulen sollten bei Raumtemperatur in ihrem Originalkarton aufbewahrt werden (Ausnahmen können z. B. Affinitätssäulen sein, wie bereits erwähnt), zusammen mit einer Kopie des Analysezertifikats (Certificate of analysis, CoA)/Säulenberichts, möglicherweise auch mit einem Säulenprotokoll, um frühere Verwendungen einsehen und die Säule vor der zukünftigen Verwendung bewerten zu können.
Wie lange können Säulen aufbewahrt werden? Dies hängt von vielen Aspekten ab. Einige Säulen verändern sich auch nach 5 oder 10 Jahren Aufbewahrung nicht. Wenn Sie sich entscheiden, eine Säule nach einer so langen Aufbewahrung zu verwenden, gehen Sie davon aus, dass die Säule höchstwahrscheinlich ausgetrocknet ist und erneut benetzt werden muss, indem Sie sie zuerst mit 100 % Acetonitril (RP-Phasen) spülen und dann in der mobilen Phase für ca. 1 h äquilibrieren, bevor Sie Selektivitätsmessungen vornehmen. Außerdem können Sie möglicherweise eine Säulen-Testmischung durchführen und die Daten mit dem CoA vergleichen.
Die korrekte Aufbewahrung der Säule ist für eine ordnungsgemäße Chromatographie und längere Lebensdauer der Säule unerlässlich. Zu guter Letzt: Befolgen Sie stets die Herstellerrichtlinien für die Betriebsdaten der Säule!
Säulen-Testmischungen
Gemische zur Leistungsbewertung von HPLC-Säulen.
Gut definierte Testgemische ermöglichen die Behebung chromatographischer Probleme, die Optimierung der Systemeffizienz und Bewertung von Säulen im Rahmen von Bedingungen, unter denen ihre Leistung bekannt ist. Wir liefern unsere Testgemische in Braunglasampullen aus, um Photoabbau zu verhindern, und legen eine Anleitung für die ordnungsgemäße Verwendung und Auswertung der Ergebnisse bei.
VORBEUGUNG UND BEHEBUNG HÄUFIG AUFTRETENDER MATERIALPROBLEME
Leckagen vorbeugen
Leckagen sind in HPLC-Analysen ein häufig auftretendes Problem. Um Leckagen in Ihrem System zu minimieren wird empfohlen, den Austausch von Materialien und Anschlüssen verschiedener Hersteller zu vermeiden. Inkompatible Anschlüsse können vielleicht zunächst mit Kraft zusammengefügt werden, aber die Trennung kann zu Problemen und die wiederholte Herstellung der Verbindungen schließlich dazu führen, dass der Anschluss undicht wird. Wenn ein Austausch unbedingt erforderlich ist, ist es wichtig, geeignete Adapter zu verwenden und vor dem Fortfahren alle Anschlüsse auf Lecks zu prüfen.
Hochkonzentrierte Salze (> 0,2 M) und ätzende mobile Phasen können die Effizienz der Pumpendichtung verringern. Die Lebensdauer der Injektorenrotordichtungen hängt auch von den Bedingungen der mobilen Phase ab, insbesondere bei Betrieb mit hohem pH-Wert. In einigen Fällen hat die längere Verwendung von Ionenpaarreagenzien eine Schmierwirkung auf die Pumpenkolben, was zu kleinen Lecks an der Dichtung führen kann. Einige Dichtungen vertragen sich nicht gut mit bestimmten Lösungsmitteln. Bevor eine Pumpe unter ungünstigen Bedingungen eingesetzt wird, lesen Sie die Spezifikationen des Geräteherstellers oder wenden Sie sich an einen Wartungstechniker. Informationen zum Austauschen der Dichtungen finden Sie im Abschnitt „Wartung“ im Pumpenhandbuch oder wenden Sie sich an Ihren Servicetechniker.
Entfernen von Verstopfungen der Säulenfritte
Eine verstopfte Säulenfritte ist ein weiteres in der HPLC häufig auftretendes Problem. Um dieses Problem von vornherein zu minimieren, verwenden Sie einen Vorsäulenfilter und eine Vorsäule. Um den Einlass zu reinigen, wird zunächst die Säule abgenommen und umgekehrt. Diese wird an die Pumpe (aber nicht an den Detektor) angeschlossen und das Lösungsmittel mit der zweifachen Standardfließrate durchgepumpt. Etwa 5-10 Säulenvolumina Lösungsmittel sollten ausreichen, um kleine auf der Einlassfritte befindliche Partikelmengen zu lösen. Die Leistung der gereinigten Säule wird anhand eines Standard-Testgemischs bewertet.
EINE AUSWAHL VON PRODUKTEN ZUM SCHUTZ VON SÄULEN
Supelco® Filtrationsapparatur für die mobile Phase (Anschluss an Saugleitung)
- Filtrationsapparatur 1 (Anschluss an 1000-ml-Seitenarmkolben): Beinhaltet einen 250-ml-Glasbehälter, Trichterboden und Stopfen, Klemme, Edelstahlhalter und -sieb, 10 Teflondichtungen, 50 Nylon 66-Filter (47 mm, Porengröße 0,45 μm).
- Filtrationsapparatur 2 (Anschluss an Ansaugleitung): Beinhaltet einen 250-ml-Glasbehälter, einen 34/45 konisch zulaufenden Trichterboden, einen 34/45 konischen 1000-ml-Kolben und eine Glaskappe, Edelstahlhalter und -sieb, 10 Teflondichtungen, 50 Nylon 66-Filter (47 mm, Porengröße 0,45 μm).
Schützen Sie Ihr Gerät und Ihre Säulen, indem Partikel und Gase aus Lösungsmitteln und anderen Bestandteilen der mobilen Phase entfernt werden. Nylon 66-Membranfilter sind mit allen in der HPLC üblichen Lösungsmitteln kompatibel.

Filtration Apparatus 2
Filter
Ein Vorsäulenfilter ist unerlässlich, um HPLC-Säulen vor Partikeln zu schützen, die sich auf der Säulenfritte ablagern und zu Split-Peaks und hohem Rückdruck führen können. Zu den Partikelquellen gehören mobile Phasen (insbesondere, wenn Puffer mit organischen Lösungsmitteln gemischt werden), Pumpen- und Injektordichtungen und Proben. Eine 2,0 μm-Fritte zum Schutz von Säulen mit 5 μm oder größeren Partikeln oder eine 0,5 μm-Fritte für Säulen mit Partikeln unter 5 μm verwenden.

Unser Supelco® Vorsäulenfilter kann direkt und handfest an jede auf unserer Website aufgeführte HPLC-Säule oder Vorsäule oder an jede andere Säule mit Valco-kompatiblen Endstutzen angeschlossen werden. PEEK-Kappe und -Gehäuse, 2 μm-Edelstahlfritte.
Valco Vorsäulenfritten- und Siebfilter3
Inline-Installation. Effiziente Filter mit geringem Totvolumen schützen Säulen vor Partikeln, ohne die Säulenleistung zu beeinträchtigen. Die austauschbare 1/8“ Fritte hat eine Porengröße von 0,5 μm zum Schutz von 3 μm- oder 5 μm-Säulenpackungen, das austauschbare Sieb verfügt über eine Porengröße von 2 μm. Wählen Sie den Frittenfilter für eine höhere Filtrationskapazität (für die meisten Anwendungen) oder den Siebfilter für ein geringeres Totvolumen (z. B. bei Säulen mit Mikrobohrungen). Einsatz mit Schläuchen mit 1/16" Außendurchmesser; 1/16“ Anschlüsse enthalten.

Isolationstechnologie-Vorsäulenfilter
Inline-Installation. Durch den Einlassfilter mit hoher Kapazität werden das Totvolumen und die Bandenverbreiterung minimiert, um einen Verlust der Säuleneffizienz zu verhindern und gleichzeitig die Säule zu schützen. Porosität der Fritte: 0,5 μm. Vollständig wie abgebildet.

SSI-Hochdruck-Vorsäulenfilter
Inline-Installation. Die Filterscheibe aus Edelstahl 316 (Porengröße 0,5 μm) kann leicht ohne Entfernen des Endstutzens der Säule ausgetauscht werden. Maximaler Betriebsdruck: 15.000 psi (1054 kg/cm²). Für 1/16“ Schläuche.

SSI-Hochdruck-Vorinjektorfilter
Wird zwischen der Pumpe und dem Injektor für die Endfiltration der mobilen Phase angebracht. Leicht austauschbares Filterelement aus Edelstahl 316 (Porengröße 0,5 μm). Maximaler Betriebsdruck: 15000 psi (105 MPa). Für Rohre mit 1/16"-Außendurchmesser, 10-32 Gewinde

Upchurch-Vorsäulenfilter
Inline-Installation. Edelstahlgehäuse mit inerten Polyetheretherketon (PEEK) Endstutzen und einer 0,5-μm- oder 2-μm-PEEK-Fritte in einem Endstutzen.

Rheodyne-Injektoren Modelle 7725 und 7725i
Mit dem Rheodyne-Injektor Modell 7725 können 1 μl-5 ml Proben mit Genauigkeit und Präzision injiziert werden. Das robuste, leicht zu wartende Design bietet viele fortschrittliche Funktionen:
- Patentiertes Design mit kontinuierlichem Durchfluss (siehe Abbildung) – der Durchfluss wird bei Umschalten von LOAD auf INJECT nicht unterbrochen
- Einfache Einstellung der Dichtung mit der Druckschraube an der Vorderseite des Injektors.
- Weitwinkel-Port (30°) für einfachen Zugang zu den Anschlüssen
Der Injektor verfügt über eine 20 μl-Probenschleife und wird mit einer VESPEL-Rotordichtung geliefert, die für den Betrieb bei pH 0-14 durch eine Tefzel-Rotordichtung ersetzt werden kann. Werkseitig auf 5000 psi (345 bar) eingestellt, einstellbar auf 7000 psi (483 bar). Das Modell 7725i verfügt über einen internen Switch zur Positionserkennung.
Durch ein herkömmliches HPLC-Ventil wird der Fluss während der Probeninjektion kurzzeitig unterbrochen und die Säule wiederholten Druckstößen ausgesetzt. Das von Rheodyne patentierte MBB-Design (make-before-break) stellt die neue Verbindung her, bevor die alte unterbrochen wird, und sorgt so für einen ununterbrochenen Durchfluss.

Rheodyne Model 7725 injector. 1. To sample loop, 2 From pump, 3. MBB passage, 4. MBB port, 5. To column, 6. From sample loop
Pumpenersatzteile von Optimize Technologies
Ein vorbeugendes Wartungsprogramm, das den routinemäßigen Austausch von Pumpenteilen umfasst, die einem Verschleiß unterliegen. Unterstützt bei der Vermeidung kostspieliger Ausfallzeiten. Unsere umfangreiche Auswahl an Rückschlagventilen, Dichtungen und Kolben von Optimize Technologies erfüllt oder übertrifft die Spezifikationen der Pumpenhersteller. Die aktuellste Auswahl an Pumpenteilen finden Sie auf der Website.

SSI™-LO-Pulse™-Dämpfer
Ein Pulsationsdämpfer steuert die Pumpenpulsationen und sorgt so für eine stabilere Basislinie. Der SSI™-LO-Pulse™-Dämpfer ist eine patentierte Einheit, die mit Einkolben-HPLC-Hubkolbenpumpen kompatibel ist (Altex 110A, Eldex-Pumpen, LDC Mini-Pump VS, SSI-Modelle 200 und 300 usw.). Bei Drücken von 500 psi bis 6000 psi (35-420 kg/cm²) werden durch ihn die Präzision der quantitativen Analysen und die Nachweisgrenzen für Spurenprobenbestandteile verbessert. Einschließlich Stutzen und Anleitung.
Um weiterzulesen, melden Sie sich bitte an oder erstellen ein Konto.
Sie haben kein Konto?